
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция №9. Тема:Титриметрические методы анализа
|
|
|
|
Тема: Титриметрические методы анализа
Цель: сформировать представления о теоретических основах объемного анализа и его методах (кислотно-основном, комплексонометрическом, окислительно-восстановительном)
План лекции: 1) Теоретические основы объемного анализа
2) Кислотно-основное титрование
3) Комплексонометрия
4) Окислительно-восстановительное титрование
Титриметрический анализ основан на точном измерении количества реагента, израсходованного на реакцию с определяемым веществом. Титр в аналитической химии – один из способов выражения концентрации раствора. Титр показывает количество граммов растворённого вещества в 1 мл раствора:
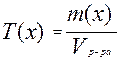
В основе титриметрического анализа лежит закон эквивалентов: массы (объемы) реагирующих веществ пропорциональны их эквивалентным массам (объемам), т.е. вещества реагируют друг с другом в эквивалентных количествах:
По закону эквивалентов вещества реагируют друг с другом в эквивалентных количествах, поэтому из формулы нормальности можно выразить количество эквивалента:
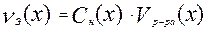
Если вещества 1 и 2 реагируют друг с другом в эквивалентных количествах, то:
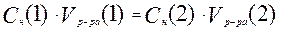 или
или 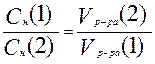
Титрование – это процесс, при котором к раствору исследуемого вещества или части раствора (аликвоте) постепенно прибавляют раствор точно известной концентрации до тех пор, пока вещества не прореагируют полностью.
Раствор, которым титруют, и концентрация которого известна с высокой точностью, называется титрованным или стандартным или титрантом или рабочим раствором.
Процесс установления концентрации титранта называется стандартизацией. Различают приготовленные и установленные растворы титрантов. Приготовленные растворы получают растворением точной навески тщательно очищенного исходного вещества в определенном объеме воды (NaCl). Но не все растворы можно так приготовить (НСl). В таких случаях готовят раствор приблизительной концентрации, а затем его стандартизируют, т. е. устанавливают точную С. Такие растворы называют установленными. Для стандартизации растворов применяют специальные установочные вещества, т.н. первичные стандарты. Первичные стандартные вещества должны удовлетворять следующим основным требованиям: высокая чистота (х.ч. или ч.д.а.); устойчивость на воздухе; отсутствие гигроскопической влаги (должны быть негигроскопичны); большая молярная масса эквивалента (что уменьшает ошибку взвешивания); доступность; нетоксичность (бура Na2B4O7 ·10H2O, Na2CO3 (бб/в)H2C2O4 · 2H2O).Сами титранты (растворы щелочей и сильных кислот, концентрация которых установлена по первичным стандартам) – вторичные стандарты.
|
|
|
Момент титрования, когда количество добавленного титранта химически эквивалентно количеству титруемого (исследуемого) вещества (момент полного связывания исследуемого соединения) называется точкой эквивалентности (ТЭ) и определяется по изменению свойств раствора (окраска, осадок).
Конечная точка титрования (КТТ) – момент или точка титрования, в которой некоторое свойство раствора (например, окраска) претерпевает заметное изменение. КТТ более или менее соответствует (ТЭ), но чаще всего не совпадает с ней.
Реакции, применяемые в титриметрии, должны соответствовать следующим требованиям:
1) реакция должна протекать количественно (необратимо, до конца), т.е. константа равновесия реакции должна быть велика {возможно, объяснить};
2) реакция должна протекать с большой скоростью (иногда для ее ускорения растворы нагревают;
3) реакция должна протекать стехиометрически, т.е. строго по уравнению без побочных реакций;
|
|
|
4) должен существовать способ определения окончания реакции, т.е. должна позволять точно и удобно определять (КТТ) вблизи точки эквивалентности (ТЭ).
Выделяют несколько способов (приемов титрования):
1) прямое титрование – исследуемое вещество непосредственно реагирует с титрантом. Для проведения анализа этим методом достаточно одного рабочего раствора известной концентрации. Применяют для определения кислот, гидроксидов (сильных и слабых), солей и их смесей, жесткости (временной) воды, кислотности и щелочности различных природных объектов.
2) обратное титрование (титрование по остатку) – при этом используется два рабочих раствора – основной и вспомогательный. Основной реагент используется для проведения необратимой количественной реакции с исследуемым веществом, а вспомогательный – для необратимой количественной реакции с избытком основного реагента. Например: определение хлорид-ионов в растворе. К анализируемому раствору хлорида сначала добавляют избыток титрованного раствора нитрата серебра (основной раствор). Образуется малорастворимый хлорид серебра:
Ag+ + Cl- → AgCl↓
Избыток нитрата серебра оттитровывают раствором тиоцианата аммония (вспомогательный раствор):
AgNO3 + NH4SCN → AgSCN↓ + NH4NO3
Ag+ + SCN- → AgSCN↓
По известным концентрациям рабочих растворов и их затраченным объемам вычисляют концентрацию хлорид ионов в исследуемом растворе:
n (KCl) = n (AgNO3) – n (NH4SCN)
3) титрование заместителя (косвенное титрование) – к раствору определяемого вещества добавляют реагент, вступающий с ним в реакцию. Один из продуктов взаимодействия оттитровывают рабочим раствором. Определение солей аммония основано на реакциях:
формальдегид уротропин
4NH4Cl + 6CH2O→ (CH2)6N4 + 4HCl + 6H2O
Выделяющуюся при этом HCl титруют стандартным раствором NaOH:
NaOH + HCl → NaCl + H2O
n (NH4Cl) = n (HCl) = n (NaOH)
|
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 2420; Нарушение авторских прав?; Мы поможем в написании вашей работы!