
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Адиабатный процесс
То
Т.к. в соответствии с первым началом термодинамики
d Q = dA + dU = RdT + 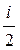 RdT =
RdT =
=(R +  R)dT = (R + СV)dT,
R)dT = (R + СV)dT,
Ср =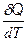 = R + СV. (2. 24)
= R + СV. (2. 24)
Это соотношение называется уравнением Майера:
Выражение для Ср можно также записать в виде:
Ср = R + 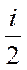 R =
R = 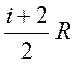 . (2. 25)
. (2. 25)
Удельную теплоемкость при постоянном давлении сp определим, разделив выражения (2.26) на m:
сp =  (2.26)
(2.26)
При изобарном сообщении газу массой m количества теплоты DQ его внутренняя энергия возрастает на величину DU = 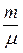 CVDT, а количество теплоты, переданное газу при изобарном процессе, DQ=
CVDT, а количество теплоты, переданное газу при изобарном процессе, DQ= 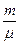 CpDT.
CpDT.
Обозначив отношение теплоемкостей  буквой g, получим
буквой g, получим
 (2.27)
(2.27)
Очевидно, g >1 и зависит только от сорта газа (числа степеней свободы).
Из формул (2.22) и (2.26) следует, что молярные теплоемкости определяются лишь числом степеней свободы и не зависят от температуры. Это утверждение справедливо в довольно широком интервале температур лишь для одноатомных газов только с поступательными степенями свободы. У двухатомных газов число степеней свободы, проявляющееся в теплоемкости, зависит от температуры. Молекула двухатомного газа обладает тремя поступательными, степенями свободы: поступательными (3), вращательными (2) и колебательными (2).
Таким образом, суммарное число степеней свободы достигает 7 и для молярной теплоемкости при постоянном объеме мы должны получить: СV = 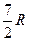 .
.
Из экспериментальной зависимости молярной теплоемкости водорода следует, что СV зависит от температуры: при низкой температуре (» 50 K) СV = , при комнатной СV =
, при комнатной СV = и очень высокой — СV =
и очень высокой — СV =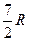 .
.

Расхождение теории и эксперимента объясняется тем, что при вычислении теплоемкости надо учитывать квантование энергии вращения и колебаний молекул (возможны не любые вращательные и колебательные энергии, а лишь определенный дискретный ряд значений энергий). Если энергия теплового движения недостаточна, например, для возбуждения колебаний, то эти колебания не вносят своего вклада в теплоемкость (соответствующая степень свободы "замораживается" — к ней неприменим закон равномерного распределения энергии). Этим объясняется последовательное (при определенных температурах) возбуждение степеней свободы, поглощающих тепловую энергию, и приведенная на рис. 13 зависимость CV = f(T).
Адиабатным (адиабатическим) процессом называется процесс, происходящий в термодинамической системе при отсутствии теплообмена с окружающими телами, т.е. при dQ = 0.
Условие Q = 0 необходимое, но недостаточное условие адиабатного процесса. Этому условию могут соответствовать процессы, при которых на одних участках система получает теплоту, а на других отдает, так что суммарная теплота полученная (отданная системой может оказаться равной нулю. При адиабатных процессах система на любых бесконечно малых участках не получает и не отдает теплоту. Практически адиабатными будут процессы, протекающие достаточно быстро и при идеальной теплоизоляции системы. Так как при адиабатном процессе
d Q = 0, а dT¹0, (2. 28)
|
Дата добавления: 2014-01-14; Просмотров: 575; Нарушение авторских прав?; Мы поможем в написании вашей работы!