
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтальпия. Т.к. связанная энергия зависит от энтропии, то энтропия является мерой связанной, бесполезной энергии
Т.к. связанная энергия зависит от энтропии, то энтропия является мерой связанной, бесполезной энергии. Следовательно, увеличение энтропии приводит к уменьшению КПД. Энтропию можно рассматривать как меру обесцененности энергии тела.
Формула (2.65) дает возможность выяснить физический смысл энтропии.
Т е. внутренняя энергия состоит из суммы свободной и связанной энергий.
При необратимом изотермическом процессе  <dS или TdS > dQ, и вместо (2.64) получим
<dS или TdS > dQ, и вместо (2.64) получим
dA< -d(U—TS), или dA< -dF, (2. 64)
т. е. при необратимом процессе работа меньше изменения свободной энергии. Свободную энергию можно рассматривать как потенциальную энергию системы, находящейся при постоянных температуре и объеме. Поэтому условием равновесия термодинамической системы будет условие минимума свободной энергии.
Если температура системы и ее объем постоянны, то в системе могут идти только такие процессы, которые приводят к уменьшению свободной энергии в случае необратимых процессов и оставляют свободную энергию неизменной при обратимых процессах. Внешней работы такая система не совершает (dV = 0).
Сообщим термодинамической системе количество теплоты dQ. Это приведет к увеличению внутренней энергии на dU и к совершению работы расширения dА. Пусть расширение происходит изобарно, тогда по первому закону термодинамики:
dQ = dU + pdV = d (U + pV)p (2. 65)
Величину U + pV называют энтальпией и обозначают буквой H:
Н = U + pV. (2. 66)
Проинтегрировав уравнение (2.67) от начального состояния 1 до конечного состояния 2, получим
DQ = U2- U1+ pV2 – pV1 =Н2-Н1, (2. 67)
Следовательно, изменение энтальпии, при равновесном изобарном процессе равно сообщенному системе количеству теплоты.
Взяв от выражения (2.68) производную по Т при р = const, получим
Сp = 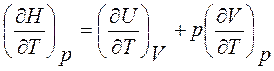
т. е. теплоемкость при постоянном давлении равна производной энтальпии по температуре при изобарном процессе.
|
|
Дата добавления: 2014-01-14; Просмотров: 414; Нарушение авторских прав?; Мы поможем в написании вашей работы!