
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фазовые переходы
Фазы — это совокупность однородных, одинаковых по своим свойствам частей системы. Различными фазами являются различные агрегатные состояния вещества – твердое, жидкое и газообразное. Если в воде находится лед, то система состоит из трех фаз: льда, воды и паров воды в воздухе. Понятие фаз является более широким, чем понятие об агрегатных состояниях; различные фазы могут существовать в пределах одного и того же агрегатного состояния. Говоря о твердом состоянии как об особой фазе вещества (отличной от жидкой фазы), мы имеем в виду лишь твердое кристаллическое состояние. Аморфное твердое тело превращается при нагревании в жидкость путем постепенного размягчения, без скачка. Переход из одной фазы в другую происходит (при заданном давлении) всегда при строго определенной температуре. Температура фазового перехода это температура, при которой имеет место тепловое равновесие между двумя фазами. В отсутствии внешних воздействий (в том числе подвода внешнего тепла) две фазы при этой температуре сосуществуют неограниченно долго. Напротив, при температурах выше или ниже точки перехода может существовать лишь одна – та или другая фаза. При изменении давления изменяется и температура фазового перехода. Если две или больше различных фаз вещества при данной температуре и давлении существуют одновременно, соприкасаясь друг с другом и если при этом масса одной из фаз не растет за счет другой, то говорят о фазовом равновесии.
Переход вещества из одного состояния (фазы) в другое называется фазовым переходом или фазовым превращением.
При определенных условиях фазы могут находиться в равновесии друг с другом. Состояния равновесия двух фаз изобразятся на диаграмме (р,Т) линией Р = f(T). Три фазы одного и того же вещества могут находиться в равновесии только при единственных значениях температуры и давления, которым на диаграмме (р,Т) соответствует тройная точка. Эта точка лежит на пересечении кривых равновесия фаз, взятых по 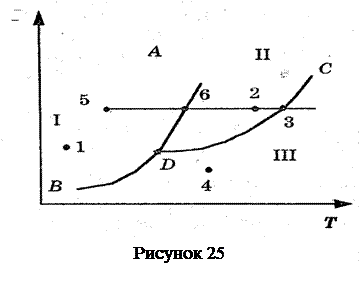 парно.
парно.
Переход из одной фазы в другую обычно сопровождается поглощением или выделением некоторого количества теплоты, которую называют скрытой теплотой перехода. Такие фазовые переходы — это переходы первого рода. Фазовые переходы, которые не связаны с поглощением или выделением теплоты и изменением объема, называются переходами второго рода (например, некоторые переходы из одной кристаллической модификации в другую). На рис. изображена примерная диаграмма состояний некоторого вещества. Линиями AD (кривая плавления), BD (кривая сублимации), DC (кривая испарения) поле диаграммы разделяется на три области, соответствующие условиям существования твердой I, жидкой II и газообразной III фаз. Точка D называется тройной точкой. Она соответствует условиям существования всех трех фаз вещества. По фазовой диаграмме легко определить, в каком состоянии находится данное вещество при заданных условиях (р и Т). Например, при условиях, соответствующих точке 2, вещество находится в жидком состоянии, при условиях, соответствующих точке 3, вещество находится одновременно в жидком и газообразном состояниях.
На диаграмме удобно изображать также процессы изменения состояния вещества. Проследим изобарическое (р = const) нагревание вещества, находящегося в твердом состоянии — точка 5. При температуре, соответствующей точке 6, тело начинает плавиться, при температуре, соответствующей точке 3, — испаряться. При дальнейшем повышении температуры целиком переходит в газообразное состояние.
|
Дата добавления: 2014-01-14; Просмотров: 991; Нарушение авторских прав?; Мы поможем в написании вашей работы!