
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства
|
|
|
|
Получение
Строение
Комплексные соли
Химические свойства.
Получение
Основные соли
Химические свойства.
Получение
Кислые соли
Химические свойства
Получение
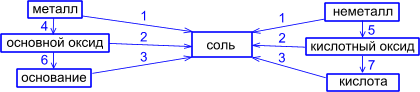
Большинство способов получения солей основано на взаимодействии веществ с противоположными свойствами:
1) металла с неметаллом:
2Na + Cl2 ® 2NaCl
2) металла с кислотой:
Zn + 2HCl ® ZnCl2 + H2
3) металла с раствором соли менее активного металла
Fe + CuSO4 ® FeSO4 + Cu
4) основного оксида с кислотным оксидом:
MgO + CO2 ® MgCO3
5) основного оксида с кислотой
CuO + H2SO4 –t°® CuSO4 + H2O
6) основания с кислотным оксидом
Ba(OH)2 + CO2 ® BaCO3¯ + H2O
7) основания с кислотой:
Ca(OH)2 + 2HCl ® CaCl2 + 2H2O
8) соли с кислотой:
MgCO3 + 2HCl ® MgCl2 + H2O + CO2
BaCl2 + H2SO4 ® BaSO4¯ + 2HCl
9) раствора основания с раствором соли:
Ba(OH)2 + Na2SO4 ® 2NaOH + BaSO4¯
10) растворов двух солей
3CaCl2 + 2Na3PO4 ® Ca3(PO4)2¯ + 6NaCl
1. Термическое разложение.
CaCO3 ® CaO + CO2
2Cu(NO3)2 ® 2CuO + 4NO2 + O2
NH4Cl ® NH3 + HCl
2. Гидролиз.
Al2S3 + 6H2O «2Al(OH)3¯ + 3H2S
FeCl3 + H2O «Fe(OH)Cl2 + HCl
Na2S + H2O «NaHS +NaOH
3. Обменные реакции с кислотами, основаниями и другими солями.
AgNO3 + HCl ® AgCl¯ + HNO3
Fe(NO3)3 + 3NaOH ® Fe(OH)3¯ + 3NaNO3
CaCl2 + Na2SiO3 ® CaSiO3¯ + 2NaCl
4. Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона.
2KMnO4 + 16HCl ® 2MnCl2 + 2KCl + 5Cl2 + 8H2O
1. Взаимодействие кислоты с недостатком основания.
KOH + H2SO4 ® KHSO4 + H2O
2. Взаимодействие основания с избытком кислотного оксида
Ca(OH)2 + 2CO2 ® Ca(HCO3)2
3. Взаимодействие средней соли с кислотой
Ca3(PO4)2 + 4H3PO4 ® 3Ca(H2PO4)2
1. Термическое разложение с образованием средней соли
|
|
|
Ca(HCO3)2 ® CaCO3¯ + CO2 + H2O
2. Взаимодействие со щёлочью. Получение средней соли.
Ba(HCO3)2 + Ba(OH)2 ® 2BaCO3¯ + 2H2O
1. Гидролиз солей, образованных слабым основанием и сильной кислотой
ZnCl2 + H2O ® [Zn(OH)]Cl + HCl
2. Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов
AlCl3 + 2NaOH ® [Al(OH)2]Cl + 2NaCl
3. Взаимодействие солей слабых кислот со средними солями
2MgCl2 + 2Na2CO3 + H2O ® [Mg(OH)]2CO3¯ + CO2 + 4NaCl
1. Термическое разложение.
[Cu(OH)]2CO3(малахит) ® 2CuO + CO2 + H2O
2. Взаимодействие с кислотой: образование средней соли.
Sn(OH)Cl + HCl «SnCl2 + H2O
| K4[Fe(CN)6] | |
| K4[Fe(CN)6] | – Внешняя сфера |
| K4[Fe(CN)6] | – Внутренняя сфера |
| K4[Fe(CN)6] | – Комплексообразователь (центральный атом) |
| K4[Fe(CN)6] | – Координационное число |
| K4[Fe(CN)6] | – Лиганд |
Центральными атомами обычно служат ионы металлов больших периодов (Co, Ni, Pt, Hg, Ag, Cu); типичными лигандами являются OH-, CN-, NH3, CO, H2O; они связаны с центральным атомом донорно-акцепторной связью.
1. Реакции солей с лигандами:
AgCl + 2NH3 ® [Ag(NH3)2]Cl
FeCl3 + 6KCN ® K3[Fe(CN)6] + 3KCl
1. Разрушение комплексов за счёт образования малорастворимых соединений:
2[Cu(NH3)2]Cl + K2S ® CuS¯ + 2KCl + 4NH3
2. Обмен лигандами между внешней и внутренней сферами.
K2[CoCl4] + 6H2O ® [Co(H2O)6]Cl2 + 2KCl
ГЕНЕТИЧЕСКАЯ СВЯЗЬ
МЕЖДУ РАЗЛИЧНЫМИ КЛАССАМИ СОЕДИНЕНИЙ
|
|
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 401; Нарушение авторских прав?; Мы поможем в написании вашей работы!