
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основні газові закони, що застосовуються для атмосферного повітря
|
|
|
|
Основний закон, який широко використовується в метеорології – це закон Клапейрона – Менделєєва. Він виражає зв’язок між об’ємом, тиском і температурою деякої маси повітря. Всі ці величини залежать одна від одної: при зміні однієї з них змінюються інші. Формула, що пов’язує ці величини також називається рівнянням стану. Воно являє собою об’єднання законів Бойля - Маріотта та Гей – Люссака.
Закон Бойля - Маріотта стверджує, що при постійній температурі тиск газу р змінюється обернено пропорційно його об’єму:
 .
.
За законом Гей – Люссака приріст об’єму даної маси газу пропорційний приросту температури при постійному тиску:
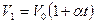 ,
,
де V1, V0 – об’єми газу при температурі 0 і t0;
 – коефіцієнт об’ємного розширення, що дорівнює
– коефіцієнт об’ємного розширення, що дорівнює  на
на  .
.
Обидва наведені закони використовуються для ідеальних газів. Але для умов атмосфери, де немає тисків, які виражаються сотнями атмосфер, і де температури далекі від абсолютного нуля, вони теж придатні.
Розглянемо деяку масу газу з об’ємом V, тиском p і температурою  . Змінимо тиск цієї маси газу від p0 до p при постійній температурі
. Змінимо тиск цієї маси газу від p0 до p при постійній температурі  , тоді згідно з законом Бойля - Маріотта, зміниться об’єм цього газу від V0 до V1 і ми одержимо:
, тоді згідно з законом Бойля - Маріотта, зміниться об’єм цього газу від V0 до V1 і ми одержимо:
p0V0 = p1V1 (1.1)
Тепер ми маємо масу газу з об’ємом  при тиску
при тиску  і температурі
і температурі 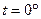 , тоді згідно з законом Гей – Люссака, отримаємо, що новий об’єм газу
, тоді згідно з законом Гей – Люссака, отримаємо, що новий об’єм газу 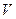 дорівнює
дорівнює
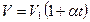
або (1.2)
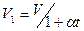 .
.
Поєднавши формули (1.1) і (1.2), одержимо
 ,
,
але
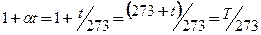 .
.
Значить
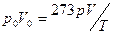 ,
,
 .
.
Величину 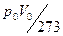 називають газовою сталою та позначають
називають газовою сталою та позначають 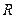 :
:
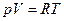 (1.3)
(1.3)
Це є рівняння стану. Але питомий об’єм V (об’єм, що займає одиниця маси) – величина зворотна густині, дорівнює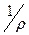 ; тоді рівняння стану можна записати в наступному вигляді:
; тоді рівняння стану можна записати в наступному вигляді:
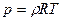 , (1.4)
, (1.4)
звідки  .
.
|
|
|
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1223; Нарушение авторских прав?; Мы поможем в написании вашей работы!