
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Условия обратимости химических реакций
|
|
|
|
Образование осадка как критерий необратимости мы фактически рассмотрели. Добавим только, что не всегда в принципе возможно обнаружить растворимость. В качестве примера реакция
Hg2+ + S2– = HgS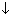 .
.
Растворимость сульфида ртути (одной из модификаций, а именно черного сульфида) составляет 1,3·10–26 моль/л. Это значит, что в 1 л такого раствора должно находиться 1,3·10–26·6,02·1023 = 0,008 молекулы. Следовательно, реакция абсолютно необратима. Здесь очевидный переход количества в качество. Уменьшение концентрации раствора возможно только до некоторого предела, пока в растворе есть растворенное вещество. После этого уже раствора нет. Заметим, что в некоторых рецептурах гомеопатов применяется такое разбавление лекарства, при котором оно в растворе отсутствует вообще.
Выделение газа. Если реакция проводится в открытой системе (в открытом сосуде) так, что газ необратимо покидает сферу реакции, то последняя истинно необратима. Если же система закрыта, то может установиться равновесие, и процесс следует считать обратимым. В качестве примера – реакция, исследованная В.Н.Ипатьевым в начале ХХ в. При давлении 350 атм и температуре около 330°С водород вытесняет из солей цинк, т.е. устанавливается равновесие:
Zn2+ + H2 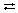 Zn + 2H+.
Zn + 2H+.
Образование слабого электролита. Двойственность ответа легко демонстрируется на примере диссоциации воды. С одной стороны, мы считаем реакцию между кислотой и щелочью необратимой. С другой – вычисляем концентрацию ионов водорода в воде, т.е. считаем, что реакция H+ + OH– 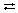 H2O
H2O
обратима. И константа равновесия для так написанного уравнения (величина, обратная ионному произведению воды) равна 1014.
Как и в случае с образованием осадка, отнесение реакции к той или иной категории зависит от конкретных обстоятельств. И здесь количество может перейти в качество. Если вычисленная константа равновесия приближается по величине к числу Авогадро, то реакция становится истинно необратимой. Практически необратимыми считаются реакции с константами равновесия большими, чем вышеприведенная константа для воды.
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 1093; Нарушение авторских прав?; Мы поможем в написании вашей работы!