
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексные соединения и их строение
|
|
|
|
Название и классификация комплексных соединений
Комплексные соединения и их строение
Основные классы неорг. соед.
Комплексные соединения.
Основными классами неорганических соединений являются оксиды, кислоты, соли и основания.
Оксиды представляют собой соединения элементов с кислородом. Оксиды подразделяют на солеобразующие и несолеобразующие. Солеобразующие оксиды делят на основные (образуют соли с кислотами), кислотные (образуют соли с основаниями) и амфотерные (образуют соли как с кислотами, так и с основаниями). Основным оксидам отвечают основания, кислотным – кислоты, а амфотерным – гидраты, которые проявляют как кислотные, так и амфотерные свойства. Кислотные оксиды представляют собой ангидриды кислот (SO2 – серный ангидрид, N2O5 – азотный ангидрид).
Примеры: N2O, NO - несолеобразующие оксиды; SO3, SiO2 - кислотные оксиды; СаО, МgО – основные оксиды и т.д.
В настоящее время общепринятой является международная номенклатура оксидов. Согласно международной номенклатуре в названии оксида указывается валентность элемента: СuO и Cu2O – оксиды меди [II] и [III] соответственно. Существует также русская номенклатура, согласно которой окисью называется единственно возможный оксид элемента, в остальных случаях название дается в соответствии с числом атомов кислорода. Оксиды, в которых элемент проявляет низшую валентность, называются закисями.
Примеры: MgO – окись магния; NiO – одноокись никеля; Ni2O3 – полутораокись никеля; Сu2О – полуокись меди.
Пероксиды (перекиси) металлов являются солями перекиси водорода Н2О2 и лишь формально относятся к оксидам. Приставка пер в названии соединений обычно указывает на принадлежность соединения к перекисным, но существуют исключения: соли кислот НMnO4 (перманганаты) и НСlO4 (перхлораты) перекисными не являются, а приставка пер в названии этих соединений указывает на максимальную насыщенность соединений кислородом.
|
|
|
Гидроксиды (основания) классифицируют по их силе (сильные – все щелочи кроме NH4OH и слабые), а также по растворимости в воде (растворимые – щелочи и нерастворимые). Важнейшими щелочами являются КОН (едкое кали) и NaOH (едкий натр).
В состав кислот входит водород, способный замещаться металлом, а также кислотный остаток. Коэффициент х, отвечающий количеству атомов водорода, а, следовательно, равный валентности кислотного остатка, называют основностью кислоты. Кислоты классифицируют по их силе (H2SO4, HNO3 – сильные кислоты; HCN – слабая кислота), на кислородсодержащие (H2SO4, HNO3) и бескислородные (HCN, HI); а также по основности (х) -
HCN – одноосновная кислота, H2SO3 – двухосновная кислота, H3РO4 – трехосновная кислота. Важнейшим свойством кислот является их способность образовывать соли с основаниями. Названия кислот образуют от того элемента, которым образована кислота, при этом названия бескислородных кислот оканчивается словом водород (HCN –циановодород или синильная кислота). Названия кислородсодержащих кислот образуют от того элемента, которым образована кислота, с добавлением слова кислота (H3AsO4 – мышьяковая кислота, H2CrO4 – хромовая кислота). В случаях, когда один элемент образует несколько кислот различие между кислотами проявляют в окончаниях названий (на ная или овая оканчиваются названия тех кислот, в которых элемент проявляет наивысшую валентность; на истая или овистая оканчиваются названия тех кислот, в которых элемент проявляет валентность ниже максимальной).
Примеры: HNO3 – азотная кислота, а HNO2 - азотистая кислота; H3AsO4 – мышьяковая кислота, а H3AsO3 – мышьяковистая кислота.
Одному и тому же оксиду могут соответствовать несколько кислот, при этом наиболее богатая водой форма имеет в названии приставку орто, а наименее богатая – мета (ортофосфорная кислота H3РO4 – на одну молекулу ангидрида Р2О5 приходится три молекулы воды; метафосфорная кислота HРO3 – на одну молекулу ангидрида Р2О5 приходится одна молекула воды). Следует также учитывать и то, что ряд кислот имеют исторически сложившиеся названия.
|
|
|
Соли являются продуктом замещения водорода в кислоте на металл или гидроксогрупп в основании на кислотный остаток. Нормальные (средние) соли получаются при полном замещении; кислые – при неполном замещении водорода кислоты на металл; основные – при неполном замещении гидроксогрупп основания на кислотный остаток. Кислая соль может быть образована только кислотой, основность которой 2 и более, а основная – металлом, заряд которого 2 и более.
Примеры: NaHS, KHCO3 – кислые соли (гидросульфид натрия и гидрокарбонат натрия); MgOHCl, CaOHCl – основные соли (хлориды гидроксо магния и кальция); NaCl, CuS – нормальные соли (хлорид натрия и сульфид меди).
| Название кислоты | Формула | Пример соли | Название соли |
| Серная | H2SO4 | K2SO4 | сульфат К |
| сернистая | H2SO3 | Na2SO3 | сульфит Na |
| соляная | HCl | Ca(Cl)2 | хлорид Са |
| иодоводородная | HI | KI | иодид К |
| сероводородная | H2S | Na2S | cульфид Na |
| азотная | HNO3 | KNO3 | нитрат К |
| азотистая | HNO2 | NaNO2 | нитрит Na |
| ортофосфорная | H3РO4 | K3РO4 | ортофосфат К |
| хлорная | НСlO4 | NaСlO4 | перхлорат Na |
| хлорноватая | НClO3 | NaСlO3 | хлорат Na |
| хлористая | НClO2 | NaСlO2 | хлорит Na |
| хлорноватистая | НСlO | NaСlO | гипохлорит Na |
| кремниевая | H2SiO3 | CaSiO3 | силикат Сa |
Продолжение табл.
| Название кислоты | Формула | Пример соли | Название соли |
| алюминиевая | H3AlO3 | K3AlO3 | алюминат К |
| ортоборная | H3BO3 | K3BO3 | ортоборат К |
| мышьяковая | H3AsO4 | K3AsO4 | арсенат К |
| мышьяковистая | H3AsO3 | K3AsO3 | арсенит К |
| двуфосфорная | H4P2O7 | K4P2O7 | дифосфат К |
| угольная | H2CO3 | K2CO3 | карбонат К |
| фосфористая | H3PO3 | K3PO3 | фосфит К |
| фтороводород | HF | KF | фторид К |
| хромовая | Н2СrO4 | K2СrO4 | хромат К |
| синильная | НCN | KCN | цианид К |
Существует большой класс химических веществ, которые образованы в результате соединения друг с другом нейтральных молекул без образования связывающих электрических пар: СuSO4 + 5Н2O = СuSO4*5Н2O.
|
|
|
Они диссоциируют в растворе с образованием простых ионов. Но часть из таких веществ диссоциируют с образованием сложных (комплексных) соединений. То есть молекулярные соединения, образующие комплексные ионы, способные существовать как в растворе, так и в кристалле, называется комплексными: К3[Fе(СN)6] «3К++ [Fе(СN)6]3-.
Основополагающие представления о комплексных соединениях ввел в науку швейцарский ученый Альфред Веринер (1898). По Вернеру, в большинстве комплексных соединений различают внутреннюю и внешнюю сферы. Например, в КС К2[ВеF4] внутреннюю сферу составляют [ВеF4]2-, а внешнюю 2K+. Центральный атом внутренней сферы называется комплексообразователем (Ве), координированные вокруг него ионы - лигандами.
В современной лабораторной практике чаще всего имеют дело с соединениями в твердом и растворенном состоянии. Для этих условий можно дать следующие определение: комплексными соединениями называют соединения, способные к самостоятельному существованию в растворе.
По характеру электрического заряда различают катионные, анионные и нейтральные комплексы. Катионный комплекс можно рассматривать как образованный в результате координации вокруг положительного иона нейтральных молекул (Н2О, NH3), например [А1(Н2O)б]3+. В анионном комплексе в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются атомы с отрицательной степенью окисления (анионы), например, [ВеF4].
Нейтральные комплексы образуются при координации вокруг атома молекул, а так же при одновременной координации вокруг иона комплексообразователя отрицательных ионов и молекул, например [Рt (NH3)2С12]°.
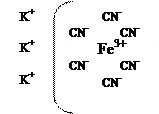 Рассмотрим строение сложного комплексного соединения К3[Fе(СN)6], оно может быть изображено:
Рассмотрим строение сложного комплексного соединения К3[Fе(СN)6], оно может быть изображено:
3К+ - составляют внешнюю сферу комплекса так как внутренняя сфера заряжена (-)-то это анионный комплекс. ион Fе3+ – ион комплексообразователь, 6СN- - лиганды. Причем, число лигандов скоординированных вокруг иона комплексообразователь называется координационным числом. В данном случае оно равно 6.
|
|
|
Ионами комплексообразователя являются как правилоd - элементы из периодической системы Менделеева: Аg+, Аu+, Сu+, Сu2+, Нg2+, Zn2+, Fе2+, Fе3+, Со3+, Ni 2+, Рt 4+ и другие. Комплексообразователями могут быть и некоторые неметаллы, например Н2[Si F6].
Координационные числа ионов комплексообразователей имеют следующие значения:
2: Аg+, Аu+, Сu+.
4: Сu2+, Нg2+, Аu3+, Сd2+, Рb2+ Рt 2+ Рd 2+.
6: Fе2+, Fе3+, Сr3+, Сo2+, Ni 2+, А13+, Zn2+, Рt 4+, Рb4+.
8: Са2+, Sr2+, Ва2+.
Заряд комплексного иона равен алгебраической сумме зарядов иона комплексообразователя и лигандов.
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 1380; Нарушение авторских прав?; Мы поможем в написании вашей работы!