
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второе начало термодинамики и живой организм
|
|
|
|
Если справедливость I начала термодинамики для живых организмов никогда не подвергалась сомнению, то приложимость к биологическим объектам второго начала вызывала оживленные дискуссии. В самом деле, энтропия любого организма в процессе жизни не возрастает, как это как будто бы следует из II начала, а остается более или менее постоянной. Некоторые ученые считали этот признак даже наиболее характерной отличительной чертой жизни. Например, выдающийся советский биолог Э. С. Бауэр сформулировал принцип «устойчивого неравновесия», согласно которому неживые системы всегда стремятся к состоянию равновесия (что сопровождается возрастанием энтропии), тогда как живые организмы поддерживают неравновесное состояние с постоянной энтропией за счет своей свободной энергии. В этом вообще-то правильном положении есть существенная неточность, о чем будет сказано далее. Важно отметить, что некоторые виталистически настроенные ученые выдвигали концепцию особой «антиэнтропийной» миссии жизни, обусловленной некоей «жизненной силой». Сейчас стало очевидным, что все подобные рассуждения, которые еще встречаются в популярной литературе, основаны на недоразумении.
Дело в том, что приведенная выше (§ 3) формулировка второго начала термодинамики, на которую ссылаются авторы всех таких умозаключений, справедлива только для изолированных систем, а биологическая система в принципе не может быть изолированной, так как непременным условием жизни является обмен веществ и энергии с окружающей средой. Чтобы применять второе начало термодинамики в биологии, необходимо сформулировать его для открытых систем.
Термодинамика открытых систем разработэна сравнительно недавно (в 50—60-е годы текущего столетия) рядом ученых, среди которых особое место занимает И. Р. Пригожий, удостоенный за эти работы Нобелевской премии. Основная идея Пригожина довольно проста. Полное изменение энтропии открытой системы нужно представить в виде двух частей: причиной первой из них (Δis) служат внутренние процессы, которые необратимы и непременно сопровождаются диссипацией энергии; вторая часть (Δes) обусловлена обменом энергией и веществом между системой и окружающей средой. Следовательно,
|
|
|
Δs= Δis + Δes
Аналогичное выражение можно написать и для изменения полной свободной энергии открытой системы:
ΔG= ΔiG + ΔeG (17)
Так как все реальные процессы в открытых системах необратимы, то Δis всегда больше нуля, a ΔiG — всегда отрицательно. Что же касается Δes(или ΔeG ), то знаки этих величин в разных ситуациях могут иметь разные значения, в ходе обмена с окружающей средой свободная энергия системы может и увеличиваться, и уменьшаться. Нетрудно догадаться, что в организме первый случай имеет место при усвоении пищи, а второй — при неблагоприятных воздействиях, вызывающих дополнительные затраты свободной энергии.
Важно отметить, что накопление свободной энергии в открытой системе (и, соответственно, уменьшение ее энтропии) всегда сопряжено с возрастанием энтропии в окружающей среде, то есть в других телах, с которыми связана исследуемая система. Рассмотрим, например, взаимосвязь фотосинтеза с процессами, происходящими на Солнце. При создании одного моля глюкозы свободная энергия растения возрастает примерно на 48000 Дж, а энтропия снижается на 160 Дж K-1 (при температуре 300 К). Синтез одной молекулы глюкозы требует поглощения трех квантов света, а в расчете на один моль — 3NA = = 18 1023 квантов. В ходе термоядерных реакций, обеспечивающих на Солнце излучение такого количества квантов, энтропия Солнца возрастает на 1800 Дж K-1. Стало быть, для компенсации снижения энтропии на 160 Дж К-1 в биосфере Земли необходима продукция энтропии 1800 Дж К-1 на Солнце.
|
|
|
В общем случае в открытой системе Δe≤≥0, причем в разные промежутки времени изменения полной энтропии могут быть различны, так как непрестанно изменяются величины Δis и Δes а у последней — и знак. В связи с этим в термодинамику открытых систем был введен параметр, который отсутствовал в классической термодинамике (термодинамике изолированных систем). Речь идет о времени. В классической термодинамике рассматриваются только установившиеся режимы, что позволяет не учитывать зависимость параметров термодинамического процесса от времени. В термодинамике открытых систем необходимо учитывать непрерывное изменение свободной энергии и энтропии, обусловленное связью таких систем с беспрестанно меняющейся внешней средой.
Поэтому при формулировке второго начала термодинамики для открытых систем целесообразно ввести величину скорости
ds/dt изменения энтропии— которая определяется выражением
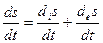
Член – dis/dt называется продукцией энтропии, а des/dt потоком энтропии.
Теперь можно сформулировать второе начало термодинамики для открытых систем: в открытых системах внутреннее изменение энтропии всегда положительно, а внутреннее изменение свободной энергии всегда отрицательно. Здесь подчеркивается необратимость реальных термодинамических процессов в открытых системах:
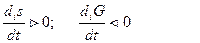
В изолированной системе des/dt = 0 и ds/dt = dis/dt Отсюда
следует «классическая» формулировка второго начала
Для поддержания жизни необходимо непрерывное поступление в организм свободной энергии из окружающей среды, чтобы пополнять беспрестанную убыль свободной энергии самого организма, идущей на выполнение работы в различных видах, и поддерживать энтропию организма постоянной. Этот процесс иногда называют потоком отрицательной энтропии в организм. Термин «отрицательная энтропия» (или «негэнтропия») довольно сложен для понимания и нередко вносит путаницу в терминологию, поэтому в последнее время им почти не пользуются. С ним связано, в частности, одно заблуждение. В литературе можно встретить высказывание, будто организм получает с пищей отрицательную энтропию, так как в пищевые продукты входят белки, нуклеиновые кислоты, полисахариды, жиры — вещества, обладающие низкой энтропией, поскольку в сложной молекуле распределение атомов упорядочено и термодинамическая вероятность такой системы низка. Однако в подобных высказываниях не учитывается, что в пищеварительном тракте все сложные молекулы расщепляются до мономеров. Они всасываются из кишечника в кровь и оттуда проникают в клетки. Именно из мономеров извлекается свободная энергия в ходе биологического окисления. Следовательно, никакой «отрицательной» и даже низкой энтропии человек не получает при усвоении пищи. Потребление пищи обеспечивает, с точки зрения термодинамики, постоянный приток в организм свободной энергии. За 60 лет жизни человек съедает около 14 тонн углеводов, по 2,5 тонны белков и жиров. Если к этому добавить 56 тонн выпитой воды, то нетрудно подсчитать, что через организм человека в течение жизни проходит масса веществ, в тысячу раз превосходящая его собственную массу. Это наглядно подтверждает, что живой организм — открытая система.
|
|
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 734; Нарушение авторских прав?; Мы поможем в написании вашей работы!