
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение типовых задач
|
|
|
|
ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Направлений: 270800.62 Строительство
Химия воды и микробиология
Задания на контрольную работу № 1
с методическими указаниями для студентов
2 курса
Профилей: Промышленное и гражданское
строительство,
Водоснабжение и водоотведение
(полная и сокращенная форма обучения)
Москва 2012
Составители: ст. преп. Журавлева М.А.
В процессе изучения курса «Химия воды и микробиология» студент должен выполнить одну контрольную работу. Решение задач и ответы на теоретические вопросы должны быть коротко, но четко обоснованы. При решении задач необходимо приводить весь ход решения и математические преобразования.
Контрольная работа должна быть аккуратно оформлена, написана четко и ясно, иметь поля для замечаний рецензента. Номера и условия задач необходимо переписывать в том порядке, в каком они указаны в задании. В начале работы следует указать учебный шифр студента, номер варианта и полный список номеров задач этого варианта. В конце работы следует дать список использованной литературы с указанием года издания.
Работа должна иметь подпись студента и дату.
Если контрольная работа не зачтена, ее следует выполнить повторно в соответствии с указаниями рецензента и представить вместе с незачтенной работой. Исправления следует выполнять в конце работы, после рецензии, а не в тексте.
Контрольная работа, выполненная не по своему варианту, преподавателем не рецензируется и не засчитывается как сданная.
Задача 1. Произведение растворимости PbCO3 равно 1,5 10-13. Вычислить массу ионов Pb, содержащихся в 1 л насыщенного раствора PbCO3.
10-13. Вычислить массу ионов Pb, содержащихся в 1 л насыщенного раствора PbCO3.
Решение. Для бинарного электролита произведение растворимости равно произведению концентрации ионов:
|
|
|

 Поскольку
Поскольку
 ,
,



То



(267 – молекулярная масса PbCO3).
Задача 2. Как изменится pH чистой воды, если к 1 л ее добавить 0,001 моля NaOH? ( 1).
1).
Решение. Поскольку ионное произведение воды

а для чистой воды имеем
 ,
,

то

Соответственно, pH среды увеличится на 4.
Задача 3. Написать молекулярные и ионные уравнения реакции солей CuSO4, Na3PO4 при их большом разбавлении. Какую реакцию будут иметь растворы этих солей?
Решение. При гидролизе солей ионы соли взаимодействуют с ионами воды H+ и OH-. Соли с многовалентными ионами гидролизуются по стадиям.
Процесс с участием CuSO4
Первая стадия гидролиза:

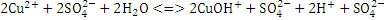
 ,
,
т.е. среда кислая, 
Вторая стадия гидролиза:



Процесс с участием 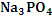
Первая стадия гидролиза:
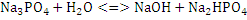


Вторая стадия гидролиза:


 +
+
Третья стадия гидролиза:


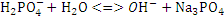 .
.
Задача 4. В воде содержатся ионы в мг/л;


Необходимо выразить концентрацию ионов в мг∙экв/л.
Решение. Для нахождения эквивалента надо массу иона разделить на валентность иона. Например, эквивалент иона натрия приблизительно равен 23 вес.ч., эквивалент иона
Mg2+ =12,15; Сl- =35,55; HCO3-=61;  =48,0;
=48,0;  =38,04; Ca2+=20,04.
=38,04; Ca2+=20,04.
Для выражения концентрации ионов в мг∙экв/л надо массу иона в мг/л разделить на эквивалент иона:


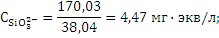



Задача 5. Какое количество извести необходимо для умягчения 1 м3 воды, если ее жесткость нужно снизить с 5 до 2 мг∙экв/л?
Решение: В соответствии с законом эквивалентов для снижения жесткости на 3 мг∙экв/л нужно добавить тоже 3 мг∙экв/л.
Сначала находим эквивалент извести:
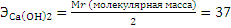 .
.
Следовательно, для понижения жесткости к 1 м3 воды надо добавить следующее количество извести:
3∙37∙1000=111000 мг=111 г.
Задача 6. Сколько граммов CaCl2 содержится в 1 м3 воды, если кальциевая жесткость равна
4 мг∙экв/л?
Решение: Для определенияколичества CaCl2 нужно жесткость воды умножить на эквивалент соли CaCl2 в 1 м3 воды:
|
|
|
4∙55,5∙1000=222 г,
ЭСаС в.ч.
в.ч.
Задача 7. Обменная способность сульфоугля равна 530 г∙экв/м3. Сколько кубометров воды может умягчить 1 м3 сульфоугля, если общая жесткость воды равна 6 мг∙экв/л?
Решение: Обменную способность сульфоугля (530 г∙экв/л) разделим на жесткость воды (530/6=88,33). Сколько раз можно пропустить воду через 1 л сульфоугля для умягчения? Для 1 м3 (1000 л) можно пропустить 88 333 л воды или 88,33 м3. Расчет производится по формуле:

где ОЕ – обменная емкость катионита, г∙экв/м3;
Ж – жесткость воды, г∙экв/л;
V – количество профильтрованной воды до появления ионов кальция в фильтрате (до 0,05 мг∙экв/л);
V1 –объем катионита, мл;
1000 – коэффициент перехода от миллиграммов к граммам и от литров к кубометрам.
Поставив данные условия задачи, получим:

откуда V =88333 л = 88,33 м3.
Задача 8. Вычислить необходимую дозу коагулянта, мг/л, снижающую щелочность коагулируемой воды на 0,7 мг∙экв/л.
Решение: в соответствии с законом эквивалентов для снижения щелочности коагулянтов требуется 0,7 мг∙экв/л.
Поскольку эквивалент Al2(SO4)3 равен 1/6 молекулярной массы соли, т.е. 57 мас.ч., то 0,7∙57=39,9 мг/л.
Задача 9. Вычислить молярную массу эквивалента хромата калия К2CrO4 как окислителя, если
К2CrO4 восстанавливается до KCrO3.
Решение: При восстановлении К2CrO4 степень окисления хрома понизится до +3. Молярная масса равна частному от деления молярной массы окислителя на число электронов, идущих на восстановление:

Аналогично рассчитывают молярную массу восстановителя при делении его молярной массы на число электронов, идущих на окисление.
Варианты контрольных заданий
Вариант контрольного задания определяется последней цифрой учебного шифра по таблице, приведенной ниже.
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 2545; Нарушение авторских прав?; Мы поможем в написании вашей работы!