
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Боровская модель атома водорода
|
|
|
|
Модель этого простейшего атома состоит из положительно заряженного ядра (+ е) и одного электрона (- е) (рис 12.5).
Пусть электрон движется со скоростью 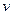 по одной из доступных ему траекторий (rn). Запишем классическое уравнение движения электрона (II закон Ньютона) и квантовое условие Бора.
по одной из доступных ему траекторий (rn). Запишем классическое уравнение движения электрона (II закон Ньютона) и квантовое условие Бора.
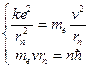 (12.2)
(12.2)
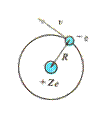
Рис. 12.5
Отсюда вытекает условие квантования орбит: электрону в атоме водорода доступны круговые орбиты следующих радиусов:
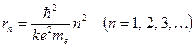 (12.3)
(12.3)
Радиус первой орбиты (n = 1) называется боровским радиусом атома r 0. Он составляет
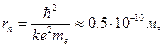
что неплохо согласуется с газокинетическим размером атома.
Вычислим внутреннюю энергию атома, которая складывается из кинетической энергии электрона и потенциальной энергии его взаимодействия с ядром. Запишем при этом и уравнение движения электрона (12.2).
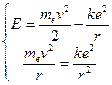
Отсюда следует, что энергия атома
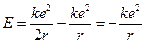 (12.4)
(12.4)
Воспользовавшись результатом (12.3) 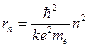 , получим спектр энергий, доступных атому:
, получим спектр энергий, доступных атому:
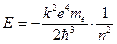 (12.5)
(12.5)
При переходе электрона с «n» орбиты на «m»-ю, атом излучает фотон. Его энергия
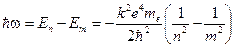 (12.6)
(12.6)
Частота этого излучения определяет одну из линий в спектре атома водорода.
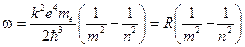 (12.7)
(12.7)
Сравнивая этот результат с обобщенной формулой Бальмера, приходим к выводу, что 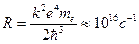 — постоянная Ридберга.
— постоянная Ридберга.
Поразительно численное совпадение этой константы, рассчитанное по Бору, с тем значением, которое было получено в результате анализа спектра излучения атома водорода!
Таким образом, уравнение (12.7) дает все частоты, присутствующие в излучении атома водорода. Это был грандиозный успех планетарной модели атома Резерфорда и Боровской теории этой модели.
Теперь понятно, как возникают спектральные линии и серии в атомарном излучении.
На рисунке 12.6 представлен масштабный чертеж пяти низших Боровских орбит водорода.
|
|
|
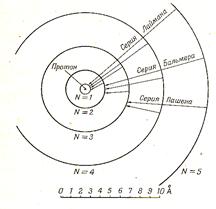
Рис. 12.6
При движении электрона по одной из этих доступных ему орбит, атом находится в стационарном состоянии и не излучает и не поглощает энергию.
При переходе электрона, например, со второй орбиты (N = 2) на первую (N = 1) излучается фотон соответствующей частоты. В спектре излучения этот переход отмечен одной из линий в серии Лаймена.
Эта серия включает частоты фотонов, излучаемых при переходе с любой орбиты на первую.
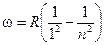
Все переходы с орбит n > 2 на вторую рождают различные линии серии Бальмера:
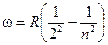 .
.
И так далее.
Боровская теория наглядно объясняет и комбинационный принцип Ритца.
Обратный переход электрона с одной из нижних орбит на более высокую возможен лишь при поглощении атомом энергии извне.
Прямым экспериментальным подтверждением квантованности электронных орбит в атоме и его энергии явился эксперимент Франка и Герца.
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 607; Нарушение авторских прав?; Мы поможем в написании вашей работы!