
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Качественный и количественный анализ
Отмеривание, отвешивание, растворение
Расчет количеств воды и лекарственного вещества
Расчет количества лекарственного вещества зависит от концентрации раствора и его объема.
Пример. Приготовить 1 л 5% раствора:
5,0 г – 100мл
х г – 1000 мл х = 50,0 г
Расчет количества воды будет зависеть от способа приготовления.
Пример. Изготовить 1 л 5% (1:20) раствора натрия гидрокарбоната.
1. Изготовление раствора с использованием мерной посуды.
В сухую стерильную мерную колбу вместимостью 1 л через сухую воронку насыпают 50,0 г натрия гидрокарбоната и добавляют для растворения около 500 мл воды очищенной, поскольку растворимость, натрия гидрокарбоната по ГФ X, ст. 430 – «растворим в воде». Согласно статье «Растворимость» в ГФ XI, вып. I, с. 175 – это значит, что 1 г препарата растворяется в 10–30 мл воды. После растворения доводят водой до метки.
2. Расчет количества воды с учетом плотности 5% раствора натрия гидрокарбоната проводится по формуле:
m = V × r
где m – масса приготавливаемого раствора (г);
V – его объем (мл);
r– плотность раствора (г/мл).
Плотность 5% раствора натрия гидрокарбоната составляет 1,033. Macca 1 л 5% раствора натрия гидрокарбоната равна: m = 1000 ×1,033 = 1033,0 г
Натрия гидрокарбоната необходимо взять 50,0 г, поэтому количество воды будет составлять: 1033,0-50,0 = 983,0 мл (плотность воды равна 1,0).
3. Расчет количества воды с учетом коэффициента увеличения объема. КУО для натрия гидрокарбоната равен 0,3 мл/г. Тогда количество воды для приготовления 1 л 5% раствора натрия гидрокарбоната составит: 1000 - (0,3 × 50,0) = 985,0 мл. При сравнении полученных объемов воды наблюдается небольшая разница (2 мл), что объясняется ошибкой опыта при определении как плотности раствора, так и коэффициента увеличения объема.
Лекарственные вещества отвешивают на ручных и тарирных весах в зависимости от объемов приготавливаемых растворов. Воду отмеривают мерными колбами, цилиндрами. Растворение лекарственных веществ при изготовлении концентрированных растворов проводится в стерильной подставке, куда отмеривают рассчитанное количество свежеперегнанной воды очищенной и отвешивают необходимое количество лекарственного вещества. Для ускорения растворения раствор перемешивают стерильной стеклянной палочкой.
Изготовленный раствор передастся на анализ химику-аналитику, где его подвергают полному химическому контролю на подлинность и количественное содержание действующего вещества (приказ РФ №214 от 16.07.97). Качественному анализу подвергаются ежедневно концентраты в бюреточной установке, находящиеся в ассистентской комнате. Количественное содержание препарата определяют с помощью рефрактометрических таблиц или рассчитывают по формуле:

где: х – концентрация раствора, %,
N – показатель преломления раствора,
N o – показатель преломления очищенной воды (1,333),
F – величина прироста показателя преломления при увеличении концентрации на 1 %.
Концентрация раствора при количественном определении может оказаться выше или ниже требуемой, тогда необходимо исправить концентрацию. Нормы допустимых отклонений при приготовлении лекарственных форм в аптеках утверждены приказом МЗ РФ №305 от 16.10.97.
Отклонения, допустимые в концентратах:
– при содержании вещества до 20% не более ± 2% от обозначенного процента;
– при содержании вещества свыше 20% не более ± 1 % от обозначенного процента.
Например, допустимые отклонения для 10% раствора – от 9,8 до 10,2% (±2%); для 30% раствора – от 29,7 до 30,3% (±1%) для 50% раствора – от 49,5 до 50,5%.
Пример. Изготовить 500 мл 20% раствора натрия бромида.
1. Анализом установлено, что изготовленный раствор оказался крепче требуемого – 23%. Норма допустимого отклонения по приказу № 305 составляет не более ±2%, а в нашем случае +15%.
0,4% – 2%
3% – х 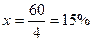
Следовательно, необходимо разбавить раствор.
Разбавление проводят по формуле:
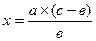
х – количество воды, необходимое для разбавления раствора, мл;
а – количество изготовленного раствора, мл,
в – требуемая концентрация раствора, %;
с – фактическая концентрация раствора, %.
Тогда  мл
мл
Таким образом, для исправления концентрации к 500 мл изготовленного раствора натрия бромида необходимо добавить 75 мл воды.
2. Анализом установлено, что изготовленный раствор слабее требуемого – 18 % Норма допустимого отклонения по приказу № 305 составляет ±2%, а в нашем случае – 10%.
Укрепление раствора производят по формуле:
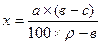
где х – количество лекарственного вещества для укрепления раствора, г;
r – плотность раствора требуемой концентрации, г/мл;
а – количество приготовленного раствора, мл;
в – требуемая концентрация раствора, %;
с – фактическая концентрация раствора, %.
Плотность 20% раствора натрия бромида равна 1,148.
Тогда: 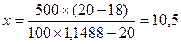 г
г
Таким образом, для исправления концентрации в 500 мл полученного раствора растворяют 10,5 г натрия бромида.
После укрепления или разбавления раствор повторно проверяют на содержание действующего вещества и в случае положительного анализа раствор фильтруют.
|
|
Дата добавления: 2014-01-15; Просмотров: 1996; Нарушение авторских прав?; Мы поможем в написании вашей работы!