
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные свойства коллоидных растворов
|
|
|
|
Растворы защищенных коллоидов.
Растворы твинов.
Растворы спенов.
Спены – производные шестиатомного спирта сорбита и высших жирных кислот. Если радикалом является остаток стеариновой кислоты получается спен-80 (сорбитанмоностеарат), при этерерификации олеиновой кислотой – спен-60 (сорбитанмоноолеат). Спены – липофильные соединения хорошо растворимы в спирте, маслах не растворимы в холодной и горячей воде. Образует эмульсию типа в/м.
Твины – полиоксильные производные спенов. Твин-60 – полиоксиэтиленсорбитанмоностеарат, твин-80 – полиоксиэтиленсорбитанмоноолеат. Твины хорошо растворяются в воде и применяются для стабилизации эмульсий типа м/в.
Коллоидные растворы (золи) – ультрамикрогетерогенные системы, в которых дисперсная фаза нерастворима в дисперсионной среде.
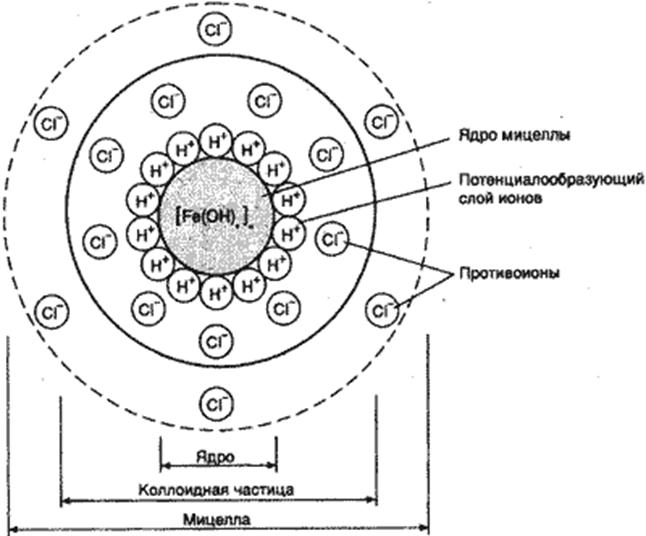
В коллоидных растворах каждая частица является не просто дисперстной частицей в виде полимолекулярного агрегата коллоидных размеров с определенными физическими свойствами (кинетической подвижностью –электрическим зарядом и т.д.), а представляет собой весьма сложное образование. Такое образование получило название-мицелла (размер от 10-7 до 10-9 м). В состав мицеллы входят: ядро кристаллической структуры или аморфного строения, двойной электрический слой из гидратированных ионов, диффузная часть двойного слоя, состоящего из противоионов. На поверхности ядра прочно адсорбированы ионы, которые определяют характер заряда частицы (потенциалопределяющие ионы). За слоем потенциалопределяющих адсорбированных ионов следует слой противоионов, который составляет адсорбционную оболочку (среду) мицеллы. Ядро вместе с адсорбционной оболочкой называют коллоидной частицей (или гранулой), потому что она имеет конкретную физическую поверхность и обеспечивает гетерогенность коллиодных растворов. Остальное количество противоионов располагается во внешней части мицеллы. Эти противоионы способны к проникновению диффузии в дисперсионную среду, образуя диффузионную оболочку-сферу. В целом, мицелла электронейтральна, хотя гранула всегда имеет заряд.
|
|
|
В отличие от истинных растворов, золи это – двухфазные система с мицелярной степенью дисперсности, частицы дисперсной фазы не видимы в обыкновенном и даже иммерсионном микроскопе (разрешающая способность 2 нм) и обнаруживаются только в ультрамикроскопе. Кроме этого коллоидные растворы обладают очень низким осмотическим давлением (в единице объёма коллоидного раствора в десятки и сотни раз меньшее число молекул, чем в единице объёма истинного раствора), а так же возможностью механического отделения дисперсной фазы от дисперсионной среды при помощи ультрафильтров. Через обычные фильтры (размеры пор 4-120мкм) коллоидные частицы могут проходить, поэтому золи можно фильтровать, если отсутствует опасность адсорбции частиц фильтрующими перегородками. Фильтровальная бумага при смачивании приобретает отрицательный заряд и при фильтровании коллоидов с положительным зарядом на поверхности они адсорбируются, что ведёт к потере дисперсной фазы.
Строение мицеллы:
Достаточно большой размер поперечника коллоидных частиц объясняет то, что они рассеивают свет, благодаря чему в отражённом свете коллоидные растворы опалесцируют или даже мутнеют (эффект Тиндаля). В проходящем свете золи прозрачны. Благодаря большим размерам частиц диффузионные процессы в коллоидных растворах выражены слабо, растворы не проходят через полупроницаемую мембрану (не диализируют).
С технологической точки зрения наиболее важным свойством коллоидных растворов является их высокая степень лабильности. Под влиянием различных факторов, например, добавление незначительного количества электролита, механической обработки, действие света, а иногда самопроизвольно без каких-либо видимых причин коллоидные растворы подвергаются разрушению. Коллоидные растворы термодинамически не устойчивые системы. В них сильно развита межфазная поверхность (она достигает максимальной величины), поэтому наблюдается максимальный запас свободной поверхностной энергии (вследствие второго закона термодинамики).
|
|
|
Различают три вида устойчивости гетерогенных систем:
– седиментационную - способность частиц дисперсной фазы находиться во взвешенном состоянии т. е. не оседать под действием силы тяжести;
– агрегативную - способность частиц дисперсной фазы не изменять свои размеры во времени, т. е. противостоять слипанию (агрегации);
– конденсационную - способность частиц дисперсной фазы сохранять свою индивидуальность в образовавшемся агрегате (т. е. противостоять конденсации).
Относительная устойчивость коллоидных растворов обусловлена наличием двойного электрического слоя на поверхности частиц дисперсной фазы, гидратацией противоионов, а так же наличием высокомолекулярного вещества - стабилизатора. Потеря агрегативной устойчивости коллоидных растворов называется коагуляцией. В результате происходит укрупнение частиц, затем изменение степени дисперсности (потеря конденсационной устойчивости), и образование хлопьев, выпадающих в осадок или всплывающих (потеря седиментационной устойчивости). Исходя из этого, коагуляцию классифицируют на скрытую и явную. Скрытая коагуляция заключается в потере агрегативной устойчивости и слипании частиц, идёт без видимых проявлений. Явная коагуляция происходит, когда агрегаты частиц выпадают в осадок или всплывают. Скрытая коагуляция не всегда переходит в явную, этот процесс может продолжаться длительное время. В начальной стадии процесс коагуляции может быть обратимым.
Коагуляции способствуют:
– добавление веществ, вызывающих дегидратацию или понижающих диссоциацию молекул (электролитов, этанола, глицерина, сиропов);
– действие физических факторов (нагревание, охлаждение, свет, время хранения).
|
|
|

В фармацевтической практике используют главным образом две группы коллоидных веществ - защищённые коллоиды и коллоидные электролиты (полуколлоиды).
Защищённые коллоиды - комбинированные вещества, состоящие из высокодисперсного (собственно коллоидного) компонента и высокомолекулярного вещества, обладающего гидрофильными свойствами и играющего роль стабилизатора. Сущность этого явления, называемого коллоидной защитой, заключается в адсорбции высокомолекулярного вещества частицами гидрофобного. В результате этого образуется адсорбционный слой, повышающий устойчивость коллоидной системы и гидрофобные коллоидные частицы приобретают гидрофильные свойства, способны легко растворяться в воде. Благодаря защите коллоидов макромолекулами высокомолекулярных веществ, они приобретают агрегативную устойчивость, спонтанность растворения и обратимость. В фармацевтической практике нашли применение три коллоидных препарата: колларгол, протаргол (искусственно созданные защищённые коллоиды) и ихтиол (природный защищённый коллоид).
Коллоидные электролиты (полуколлоиды) - комплексы ассоциированных молекул с небольшим количеством (1-2) ионогенных групп. Полуколлоидные растворы - это системы, в которых вещество находится одновременно как в истинно растворённом, так и в коллоидном состоянии, т. е. состоит из молекул, ионов, мицелл различной дисперсности. Мицеллы образуются в результате ассоциации молекул растворённого вещества, причём повышение его концентрации способствует увеличению коллоидной фракции. Большинство полуколлоидов - электролиты, способные при распаде давать простые и ассоциированные ионы. Благодаря резко выраженной поверхностной активности полуколлоиды легко адсорбируются на многих неполярных поверхностях и гидрофилизируют их. К числу полуколлоидов, применяемых в фармацевтической практике относятся мыла, синтетические детергенты, препараты дубильных веществ и др. Некоторые органические основания (этакридина лактат) в водных растворах ведут себя как полуколлоиды.
При оформлении к отпуску коллоидных растворов и растворов полуколлоидов необходимы предупредительные надписи «Перед употреблением взбалтывать», «Хранить в прохладном, защищённом от света месте».
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 3108; Нарушение авторских прав?; Мы поможем в написании вашей работы!