
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соли аммония
|
|
|
|
Применение
Основная масса производимого аммиака используется для получения азотной кислоты и азотистых удобрений – жидкого аммиака и его водных растворов, нитрата аммония, сульфата аммония и др. Водный раствор аммиака – важный реактив для проведения различных реакций. Жидкий аммиак как растворитель широко применяется для проведения различных синтезов.
Соли аммония – это кристаллические вещества белого цвета. Образуют ионную кристаллическую решетку.
Соли аммония в водных растворах подвергаются гидролизу по катиону:
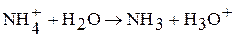
поэтому растворы солей сильных кислот имеют кислый характер среды.
Соли аммония термически неустойчивы. Природа продуктов термического разложения солей аммония определяется природой аниона:
1. Соли летучих кислот. Аммонийные соли летучих кислот при нагревании разлагаются с выделением газообразных продуктов, одним из которых является аммиак:

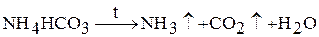
2. Соли нелетучих кислот. Аммонийные соли нелетучих кислот (сульфаты, фосфаты, силикаты и др.) при нагревании разлагаются с выделением аммиака и образованием кислоты:
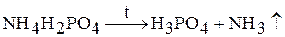
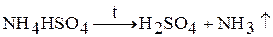
3. Соли, в которых анион является сильным окислителем. При нагревании происходит окислительно-восстановительная реакция (реакция внутримолекулярного окисления и восстановления):

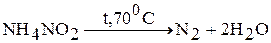

Соединения азота со степенью окисления –2
Формула гидразина N2H4 – степень окисления атома азота –2. Это соединение можно рассматривать как продукт замещения одного из атомов водорода NH3 на аминогруппу NH2, поэтому его также называют диамидом. Молекула N2H4 состоит из двух групп NH2, повернутых друг относительно друга. Молекула гидразина полярна ( Кл × м).
Кл × м).
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 2263; Нарушение авторских прав?; Мы поможем в написании вашей работы!