
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет параметров и процессов идеального газа
|
|
|
|
ПРАКТИЧЕСКИЕ ЗАНЯТИЯ
Список литературы
Лабораторные занятия
Тематика и количество лабораторных работ определяются кафедрой.
В следующей таблице приведен примерный перечень тем лабораторных занятий.
| № п/п | Темы лабораторных занятий | Кол. часов | № темы лекции | Литература |
| 1. | Построение участка нижней пограничной кривой для воды. | [1, Ч. 1, стр. 20-23] [3], [4, стр. 170 -207]. | ||
| 2. | Исследование влажного воздуха. | [1, Ч.1, стр.25-26], [2, стр 44]. | ||
| 3. | Определение коэффициента теплопроводности материала методом цилиндрического слоя. | [1, Ч.1, стр.43-44, 52-53], [2, стр. 70-72, 97-100]. | ||
| 4. | Определение коэффициента теплоотдачи при свободном движении воздуха. | [1, Ч.1, стр.45-48], [2, стр 77-86], |
1. Буянов О.Н. Тепло - и хладоснабжение предприятий пищевой промышленности. Учебное пособие. Часть1, Часть 2. -.Кемерово, 2001.- 222 с.
2. Теплотехника: Учебник для вузов /Под ред. А.П. Баскакова. – М.: Энергоиздат, 1991. – 224 с.
3. Ривкин С.Л., Александров А.А. Термодинамические свойства воды и водяного пара: Справочник. Рек. Гос. Службой стандартных справочных данных. – М.: Энергоиздат, 1984. - 80 с.
4. Рабинович О.М. Сборник задач по технической термодинамике. М.: Машиностроение, 1973. - 344 с.
5. Самойлов А.И. Сборник задач по термодинамическим процессам и процессам теплообмена в машинах и аппаратах холодильных установок. - М.: Легкая и пищевая промышленность, 1984. – 144 с.
Для изучения теплотехники можно использовать другие учебники для ВУЗов по этой дисциплине.
На практических занятиях решаются задачи по основным разделам курса. Наибольшее внимание уделяется усвоению законов термодинамики и теплообмена, методам расчета и анализа процессов и циклов энергетических установок.
|
|
|
Основными параметрами состояния являются: удельный объем, абсолютная температура, абсолютное давление.
Удельный объем v, м3/кг:
v =V/m = 1/ρ,
где V, м3 – объем, m, кг –масса, ρ, кг/м3 –плотность.
Абсолютная температура Т, К:
Т = 273,15 + t.
Абсолютное давление р, Па:
р = ратм + ризб,
р = ратм – рвак.
где: ратм – атмосферное давление,
ризб – избыточное давление,
рвак – вакуумное давление.
Связь между единицами измерения:
1кПа = 103 Па; 1МПа = 106 Па,
1бар = 105 Па = 100 кПа,
1ат = 1 кгс/см2 = 98000 Па = 98 кПа,
1мм. рт. ст. =133,3 Па.
В технической термодинамике рассматривают следующие основные термодинамические процессы:
изохорный – при постоянном объеме (v = const),
изобарный - при постоянном давлении (р = const),
изотермический – при постоянной температуре (Т = const),
адиабатный – без внешнего теплообмена (δq = 0),
политропный – при постоянной теплоемкости.
Характеристики, относящиеся к 1 кг вещества, называются удельными, они обозначаются строчными буквами, а характеристики, относящиеся к полной массе – заглавными. Полные характеристики получаются умножением удельных на величину массы:
Q =m∙q, L = m∙ℓ.
Уравнение состояния идеального газа:
p×v = R×T для 1 кг идеального газа;
p×V=m×R×T при расчетах с произвольной массой m,
где R, Дж/(кг×К) – удельная газовая постоянная (таблица 1 Приложения).
R=Rμ /μ = 8,31451×103/μ.
1 закон термодинамики:
q = Δu + ℓ.
В таблице 1 приведены формулы для расчета процессов.
Таблица 1.
| Процесс | Связь параметров | Работа изменения объема | Теплота |
| Изохорный | p2/p1 = T2/T1 | ℓ = 0 | q = cv (T2-T1) |
| Изобарный | v2/v1 = T2/T1 | ℓ = p (v2 -v1) | q = cp (T2-T1) |
| Изотермический | p2/p1 = v1/v2 | ℓ =RT ln (v2/v1) ℓ =RT ln (p1/p2) | q = ℓ |
| Адиабатный | р2/ р1 = (v1/v2)k T2/T1 = (v1/v2)k-1 T2/T1 = (р2/р1)(k-1)/k | 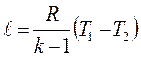
| q = 0 |
| Политропный | р2/ р1 = (v1/v2)n T2/T1 = (v1/v2)n-1 T2/T1 = (р2/р1)(n-1)/n | 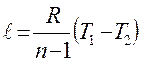
| 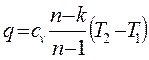
|
Изменение внутренней энергии идеального газа в термодинамическом процессе:
|
|
|
Δu = cv∙(T2-Т1).
Изменение энтальпии идеального газа в термодинамическом процессе:
Δh = cp∙(T2-Т1).
Массовые теплоемкости идеального газа cp и cv можно определить по формулам:
cp = k·R/(k-1); cv = R/(k-1),
или как отношение мольной теплоёмкости газов к молекулярной массе (таблица 2 Приложения):
cv = mсv/m, cp= mcр/m,
k = cp/cv - показатель адиабаты или коэффициент Пуассона.
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 1784; Нарушение авторских прав?; Мы поможем в написании вашей работы!