
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изотермы Ван-дер-Ваальса
|
|
|
|
Уравнение Ван-дер-Ваальса (ВдВ)
В научной литературе существуют более 150 отличающихся друг от друга уравнений состояния реального газа. Среди них нет ни одного действительно верного и универсального.
Остановимся на уравнении ВдВ (1873 г). Он внес в уравнение Клапейрона-Менделеева PV=RT две поправки.
Первая поправка связана с действием сил отталкивания между молекулами. Она учитывает собственный объем молекулы V0 и поэтому объем сосуда V заменяют свободным объемом V-b, где b =4 V0NA. В итоге получаем уравнение Клаузиуса для одного моля
P = RT/(V-b). (1)
Вторая поправка связана с действием сил притяжения между молекулами: в тонком поверхностном слое вблизи стенки сосуда на молекулу, подлетающую к стенке, действует сила притяжения со стороны остальных молекул газа, что приводит к уменьшению силы удара молекулы о стенку сосуда, а, следовательно, и давления на величину DP ~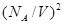 , в результате имеем P=RT/(V-b) – a/
, в результате имеем P=RT/(V-b) – a/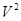 или
или
(P+ a/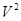 )(V-b)=RT, (2)
)(V-b)=RT, (2)
которое называют уравнением ВдВ для одного моля газа. В этом уравнении а и b – постоянные, зависящие только от вида газа.
Для произвольной массы газа уравнение ВдВ имеет вид
(P+ a/
a/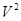 )(V-nb)= nRT, (3)
)(V-nb)= nRT, (3)
где n=m/M – число молей газа, m – масса газа, M – масса моля.
Для фиксированных значений Р и Т уравнение (2) есть уравнение третьей степени относительно объема газа V и, следовательно, оно может иметь либо три вещественных корня (V1, V2, V3), либо один вещественных корень (V1) и два комплексно-сопряженных корня (комплексно-сопряженные корни отбрасываем). Поэтому на диаграмме PV (см.рис.2) прямая, параллельная оси V может пересекать изотерму ВдВ либо в трех точках В, D, F, либо в одной K или L. Построение по точкам изотерм ВдВ для трех характерных температур приводит к кривым, изображенным на рис.2. Сначала проведем анализ нижней изотермы ABCDEFG.
|
|
|
 Левая, круто спадающая часть ее АВ соответствует жидкому состоянию, правая пологая часть FG – газообразному. Переход из жидкого состояния в газообразное и обратно при обычных условиях происходит не вдоль участка ВСDEF, а вдоль изобары BF, которая одновременно является и реальной изотермой. Такой изобаре-изотерме BF соответствуют двухфазные состояния вещества – жидкость + газ (пар). Чем ближе к точке В, тем больше жидкости, и чем ближе к точке F –тем больше в системе пара (газа). Заметим, что пар и газ – это одно и то же. Когда говорят о паре какой-либо жидкости, то этим желают подчеркнуть, что речь идет о газе, полученном испарением этой жидкости.
Левая, круто спадающая часть ее АВ соответствует жидкому состоянию, правая пологая часть FG – газообразному. Переход из жидкого состояния в газообразное и обратно при обычных условиях происходит не вдоль участка ВСDEF, а вдоль изобары BF, которая одновременно является и реальной изотермой. Такой изобаре-изотерме BF соответствуют двухфазные состояния вещества – жидкость + газ (пар). Чем ближе к точке В, тем больше жидкости, и чем ближе к точке F –тем больше в системе пара (газа). Заметим, что пар и газ – это одно и то же. Когда говорят о паре какой-либо жидкости, то этим желают подчеркнуть, что речь идет о газе, полученном испарением этой жидкости.
Ветви ВС и EF изображают метастабильные состояния вещества (т.е. относительно устойчивые состояния): перегретую жидкость и пересыщенный пар и могут быть осуществлены при определенных условиях. Участок СДЕ ни при каких условиях осуществлен быть не может.
 С ростом температуры область горбов и впадин на изотерме ВдВ уменьшается и при температуре ТКР – критической температуре – превращается в точку перегиба К с горизонтальной касательной. В точке К исчезают различия между жидкой и газообразной фазой (однородная среда).
С ростом температуры область горбов и впадин на изотерме ВдВ уменьшается и при температуре ТКР – критической температуре – превращается в точку перегиба К с горизонтальной касательной. В точке К исчезают различия между жидкой и газообразной фазой (однородная среда).
При Т>ТКР газ никаким сжатием нельзя перевести в жидкость.
Возвращаясь к анализу изотерм ВдВ, изображенных на рис.2, делаем заключение, что область, ограниченная сверху изотермой НК и справа линией КВМ соответствует жидкой фазе. Область, ограниченная сверху кривой МВКFN, соответствует жидкой и газообразной фазе (жидкость + пар) и область, расположенная правее линии НКFN, соответствует газообразной фазе.
При Т>>ТКР и относительно малых давлениях реальные газы ведут себя как идеальные газы.
Внутренняя энергия моля реального газа
U=CVТ –a/V, (4)
т.е. меньше энергии идеального газа U=CVТ. Для произвольной массы реального газа
|
|
|
U=n(CVТ –a/V). (5)
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 510; Нарушение авторских прав?; Мы поможем в написании вашей работы!