
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изотермы реального газа. Критическое состояние
|
|
|
|
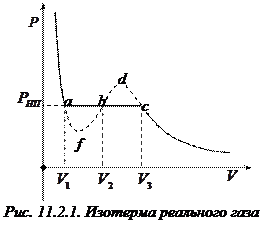 Рассмотрим процесс сжатия реального газа при постоянной температуре. Вначале по мере уменьшения объема давление газа будет расти (рис. 11.2.1). При достижении объема
Рассмотрим процесс сжатия реального газа при постоянной температуре. Вначале по мере уменьшения объема давление газа будет расти (рис. 11.2.1). При достижении объема 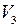 давление перестает изменяться, а вещество перестает быть однородным: часть газа конденсируется в жидкость. Происходит расслоение вещества на две фазы – жидкую и газообразную (фазой называется совокупность всех однородных по химическому составу и находящихся в одинаковом состоянии частей системы; газ и пар одного и того же вещества считают одной фазой). По мере дальнейшего уменьшения объема все большая часть вещества переходит в жидкую фазу, причем переход осуществляется при постоянном давлении
давление перестает изменяться, а вещество перестает быть однородным: часть газа конденсируется в жидкость. Происходит расслоение вещества на две фазы – жидкую и газообразную (фазой называется совокупность всех однородных по химическому составу и находящихся в одинаковом состоянии частей системы; газ и пар одного и того же вещества считают одной фазой). По мере дальнейшего уменьшения объема все большая часть вещества переходит в жидкую фазу, причем переход осуществляется при постоянном давлении  , называемого давлением (упругостью) насыщенного пара. При сжатии до объема
, называемого давлением (упругостью) насыщенного пара. При сжатии до объема  процесс конденсации пара заканчивается, и все вещество оказывается в жидком состоянии. Последующее сжатие вызывает значительное увеличение давления, обусловленное малой сжимаемостью жидкости. При любом промежуточном значении объема
процесс конденсации пара заканчивается, и все вещество оказывается в жидком состоянии. Последующее сжатие вызывает значительное увеличение давления, обусловленное малой сжимаемостью жидкости. При любом промежуточном значении объема 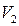 часть вещества с массой
часть вещества с массой 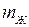 будет находиться в жидком состоянии, а часть вещества с массой
будет находиться в жидком состоянии, а часть вещества с массой 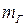 – в газообразном, причем
– в газообразном, причем

Таким образом, на диаграмме p – V состояниям равновесия между жидкостью
и ее насыщенным паром соответствует горизонтальный участок изотермы.
 При некоторых условиях удается опытным путем получить состояния, соответствующие участкам cd и af изотермы Ван-дер-Ваальса. Например, если пар тщательно отчистить от пыли и ионов, то можно наблюдать задержку конденсации, в результате которой удается сжать его до объема меньшего, чем объем насыщенного пара, и, соответственно, до давления, большего, чем давление насыщенного пара при данной температуре. Такой пар называется пересыщенным (участок cd). Но достаточно попасть в пересыщенный пар пылинке или иону, чтобы в нем возникла конденсация, сопровождающаяся скачкообразным падением давления до давления
При некоторых условиях удается опытным путем получить состояния, соответствующие участкам cd и af изотермы Ван-дер-Ваальса. Например, если пар тщательно отчистить от пыли и ионов, то можно наблюдать задержку конденсации, в результате которой удается сжать его до объема меньшего, чем объем насыщенного пара, и, соответственно, до давления, большего, чем давление насыщенного пара при данной температуре. Такой пар называется пересыщенным (участок cd). Но достаточно попасть в пересыщенный пар пылинке или иону, чтобы в нем возникла конденсация, сопровождающаяся скачкообразным падением давления до давления  . Подобным же образом при изотермическом увеличении объема сжатой жидкости можно наблюдать задержку в образовании паровой фазы (метастабильное состояние af). Состояния, соответствующее участку fbd изотермы Ван-дер-Ваальса, являются совершенно неустойчивыми и не могут быть осуществлены: при этих состояниях уменьшение объема должно сопровождаться уменьшением давления, что противоестественно.
. Подобным же образом при изотермическом увеличении объема сжатой жидкости можно наблюдать задержку в образовании паровой фазы (метастабильное состояние af). Состояния, соответствующее участку fbd изотермы Ван-дер-Ваальса, являются совершенно неустойчивыми и не могут быть осуществлены: при этих состояниях уменьшение объема должно сопровождаться уменьшением давления, что противоестественно.
|
|
|
С повышением температуры горизонтальный участок изотермы сокращается, стягиваясь в точку К при температуре  (рис. 11.2.2). Точка К – предел, к которому стремятся горизонтальные участки изотерм при стремлении температуры к критической, – называется критической точкой. Состояние, изображаемое точкой К, называется критическим. Объем
(рис. 11.2.2). Точка К – предел, к которому стремятся горизонтальные участки изотерм при стремлении температуры к критической, – называется критической точкой. Состояние, изображаемое точкой К, называется критическим. Объем 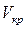 , давление
, давление 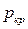 и температура
и температура  , соответствующие критическому состоянию, называются критическими параметрами.
, соответствующие критическому состоянию, называются критическими параметрами.
Критические параметры можно однозначно связать с постоянными a и b, входящими в уравнение Ван-дер-Ваальса. Уравнение Ван-дер-Ваальса – уравнение третьей степени относительно объема. Это значит, что имеется три корня – каждому значению давления  соответствует три значения объема. При критической температуре все три корня одинаковы и равны критическому объему
соответствует три значения объема. При критической температуре все три корня одинаковы и равны критическому объему  . Поэтому уравнение Ван-дер-Ваальса, записанное в виде уравнения третьей степени (для простоты символ
. Поэтому уравнение Ван-дер-Ваальса, записанное в виде уравнения третьей степени (для простоты символ  моль – опускаем),
моль – опускаем),

должно быть тождественно уравнению

Сравнивая коэффициенты у членов обоих уравнений, содержащих одинаковые степени  , можем написать:
, можем написать:

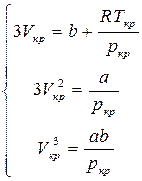
Используя эти соотношения, найдем, что
 . (11.2.1)
. (11.2.1)
При  изотермы реальных газов похожи на изотермы идеальных газов.
изотермы реальных газов похожи на изотермы идеальных газов.
Если через крайние точки горизонтальных участков семейства изотерм про-вести линию, то получится колоколообразная кривая СКМ, ограничивающая область двухфазных состояний вещества (рис. 11.2.3). Эта кривая и критическая изотерма делят диаграмму под изотермой на четыре области: под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар), слева от нее находится область жидкого состояния, справа – область пара. Выше критической изотермы – область газа. Пар отличается от газа тем, что при изотермическом сжатии претерпевает процесс сжижения, а газ при  не может быть переведен в жидкое состояние ни при каком давлении.
не может быть переведен в жидкое состояние ни при каком давлении.
|
|
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 7207; Нарушение авторских прав?; Мы поможем в написании вашей работы!