
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кристаллические и аморфные тела
|
|
|
|
 Твердые тела характеризуются значительными по величине силами межмолекулярного взаимодействия, поэтому они сохраняют свой объем и форму постоянными. Все твердые тела делятся на кристаллические и аморфные. Основой особенностью кристаллов является упорядоченность расположения частиц, составляющих кристалл (дальний порядок). Структура, для которой характерно регулярное расположение частиц с периодической повторяемостью в трех измерениях, называется кристаллической решеткой. Кристаллическая решетка может обладать различными видами симметрии.
Твердые тела характеризуются значительными по величине силами межмолекулярного взаимодействия, поэтому они сохраняют свой объем и форму постоянными. Все твердые тела делятся на кристаллические и аморфные. Основой особенностью кристаллов является упорядоченность расположения частиц, составляющих кристалл (дальний порядок). Структура, для которой характерно регулярное расположение частиц с периодической повторяемостью в трех измерениях, называется кристаллической решеткой. Кристаллическая решетка может обладать различными видами симметрии.
Внутренняя упорядоченность расположения частиц в кристаллах проявляется в правильности их внешней формы. Например, минерал кварц образует кристаллы, имеющие вид шестигранных призм, заканчивающихся шестигранными пирамидами, поваренная соль – прямоугольных параллелепипедов. Грани кристаллов располагаются симметрично, а углы между соответствующими гранями всегда остаются постоянными.
Характерной особенностью кристаллов является анизотропность – зависимость физических свойств (механических, упругих, электрических, оптических и т.д.) от направления. Анизотропность кристаллов объясняется тем, что плотность расположения частиц в кристаллической решетке по разным направлениям неодинакова (рис. 12.6.1).
В зависимости от рода частиц, расположенных в узлах кристаллической решетки, и характера сил взаимодействия между ними кристаллы делятся на четыре типа: ионные, атомные, металлические, молекулярные.
Типичными ионными кристаллами являются галоидные соединения щелочных металлов (KCl, NaBr и т.д.) и оксиды различных элементов (ZnO, MgO и т.д.). В узлах их кристаллических решеток располагаются поочередно ионы противоположного знака, а силы взаимодействия между ионами имеют кулоновский (электростатический) характер. Связь, обусловленная кулоновскими силами притяжения между разноименными заряженными ионами, называется ионной или гетерополярной.
|
|
|
В узлах кристаллической решетки атомных кристаллов располагаются нейтральные атомы, удерживающиеся ковалентными или гомеополярными связями. Валентные электроны двух соседних атомов при этом являются обобществленными. Типичными атомными кристаллами являются полупроводники (Ge и Si), алмаз и графит (два различных состояния C), некоторые неорганические соединения (ZnS).
Кристаллическая решетка металлических кристаллов (K, Na, Cu, Ag, Au и т.д.) образована положительно заряженными ионами металла. Валентные электроны, слабо связанные с атомами, легко отщепляются от них и «коллективизируются»: они принадлежат не одному атому, как в случае ионной связи, и не паре соседних атомов, как в случае ковалентной связи, а всему кристаллу в целом.
В узлах кристаллической решетки молекулярных кристаллов располагаются нейтральные молекулы вещества, силы взаимодействия между которыми обусловлены незначительным взаимным смещением электронов в электронных оболочках атомов. Эти силы называют Ван-дер-Ваальсовыми. Молекулярными кристаллами являются большинство органических соединений (резина), инертные газы (Ne, Ar, Xe) и CO2, O2, N2 в твердом состоянии лед, кристаллы йода I2. Ван-дер-Ваальсовы
силы слабые, поэтому молекулярные кристаллы легко деформируются.
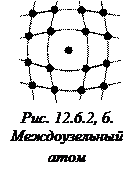
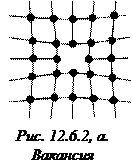 В реальных кристаллических решетках всегда имеются отклонения от упорядоченного расположения частиц в узлах решетки, называемые дефектами кристаллической решетки. Дефекты делятся на макроскопические (трещины, поры, инородные включения), возникающие в процессе зарождения и роста кристаллов, и микроскопические, обусловленные отклонения от периодичности расположения частиц в узлах решетки.
В реальных кристаллических решетках всегда имеются отклонения от упорядоченного расположения частиц в узлах решетки, называемые дефектами кристаллической решетки. Дефекты делятся на макроскопические (трещины, поры, инородные включения), возникающие в процессе зарождения и роста кристаллов, и микроскопические, обусловленные отклонения от периодичности расположения частиц в узлах решетки.
|
|
|
 Микродефекты делятся на точечные и линейные. К точечным дефектам относятся: вакансия – отсутствие атома в узле решетки (рис. 12.6.2, а); междоузельный атом – собственный атом, внедрившийся в пространство между узлами (рис. 12.6.2, б); примесный атом – атом примеси, либо замещающий атом основного вещества в кристаллической решетки (примесь замещения, рис. 12.6.2, в), либо внедрившийся в междоузельное пространство (примесь внедрения рис. 12.6.2, г). Точечные дефекты нарушают ближний порядок в кристаллах.
Микродефекты делятся на точечные и линейные. К точечным дефектам относятся: вакансия – отсутствие атома в узле решетки (рис. 12.6.2, а); междоузельный атом – собственный атом, внедрившийся в пространство между узлами (рис. 12.6.2, б); примесный атом – атом примеси, либо замещающий атом основного вещества в кристаллической решетки (примесь замещения, рис. 12.6.2, в), либо внедрившийся в междоузельное пространство (примесь внедрения рис. 12.6.2, г). Точечные дефекты нарушают ближний порядок в кристаллах.
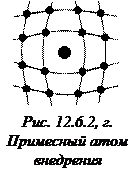 Линейные дефекты – дислокации – нарушают правильное чередование атомных плоскостей в кристаллах и, следовательно, дальний порядок. Если одна из атомных плоскостей обрывается внутри кристалла, то край этой плоскости образует краевую дислокацию. В случае винтовой дислокации атомные плоскости внутри кристалла не обрываются, а закручиваются так, что фактически кристалл состоит из одной атомной плоскости, изогнутой по винтовой поверхности. Дислокации никогда не обрываются, они либо выходят на поверхность кристалла, либо разветвляются, поэтому в реальных кристаллах образуются плоские или пространственные «сетки» дислокаций. Наличие дефектов влияет на свойства кристаллов.
Линейные дефекты – дислокации – нарушают правильное чередование атомных плоскостей в кристаллах и, следовательно, дальний порядок. Если одна из атомных плоскостей обрывается внутри кристалла, то край этой плоскости образует краевую дислокацию. В случае винтовой дислокации атомные плоскости внутри кристалла не обрываются, а закручиваются так, что фактически кристалл состоит из одной атомной плоскости, изогнутой по винтовой поверхности. Дислокации никогда не обрываются, они либо выходят на поверхность кристалла, либо разветвляются, поэтому в реальных кристаллах образуются плоские или пространственные «сетки» дислокаций. Наличие дефектов влияет на свойства кристаллов.
У аморфных тел (смолы, пластмассы, полимеры) отсутствует характерная для кристаллов строгая упорядоченность в расположении частиц, периодически повторяющаяся во всех направлениях, то есть у них отсутствует дальний порядок. В то же время у аморфных тел, так же, как у жидкостей, существует согласованность расположения в пространстве смежных атомов, то есть имеется ближний порядок. Поэтому в аморфном теле атомы в среднем размещаются с одинаковой плотностью. Это и обусловливает характерную для аморфных тел изотропность их физических свойств.
Рекомендуемая литература
1. Савельев И.В. Курс общей физики: Учебник для вузов. В 3-х т. Т.1: Механика. Молекулярная физика. – М.: Наука, 1996. – 352 с.
2. Трофимова Т.И. Курс физики: Учеб. пособие для вузов. – 6-е изд. стереотипное. – М.: Высшая школа, 2002. – 542 с. Сивухин Д.В. Общий курс физики: Т. I. Механика. – 3-е изд. – М.: Физматлит, 2004. – 656 с.
3. Волькенштейн В.С. Сборник задач по общему курсу физики: Учеб. пособие для вузов. – М.: Наука, 2004. – 327 с.
|
|
|
4. Трофимова Т.И. Сборник задач курсу физики: Учеб. пособие для студентов. – М.: Высшая школа, 2002. – 303 с.
5. Трофимова Т.И., Павлова З.Г. Сборник задач по курсу физики с решениями. – М.: Высшая школа, 2005. – 591 с.
6. Волькенштейн В.С. Все решения к «Сборнику задач по общему курсу физики» В 2 кн. – Кн.1. – М.: АСТ, 1999. – 592 с.
ПРИЛОЖЕНИЯ
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 569; Нарушение авторских прав?; Мы поможем в написании вашей работы!