
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические методы очистки
|
|
|
|
Эти методы применяют для удаления растворимых веществ в замкнутых системах водоснабжения, а иногда и для дополнительной очистки сточных вод до или после биологической очистки. Наиболее часто с помощью химической очистки удаляют ионы тяжёлых металлов. Основными приёмами химических методов очистки сточных вод являются нейтрализация, окисление – восстановление и осаждение малорастворимых соединений.
Нейтрализация применяется для обработки производственных сточных вод, содержащих щёлочи и кислоты. Предварительная нейтрализация указанных вод является обязательной процедурой перед сбросом их в водоём.
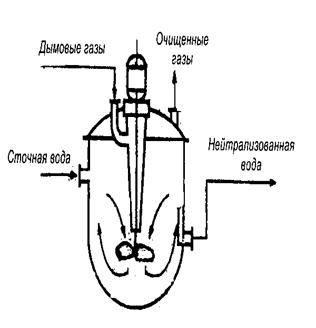
Рис. 6. Нейтрализатор сточных вод
Реакция нейтрализации в водных растворах происходит между гидратированными ионами водорода и гидроксид-ионами, содержащимися соответственно в сильных кислотах и основаниях:
H+ + OH− → H2O
Рациональным является взаимное объединение кислых и щелочных стоков, если при этом не происходит выпадения осадков в трубах и, как следствие, засорения сети.
В целях нейтрализации кислых вод применяют щелочные реагенты: известь СаО, гашёную известь Са(ОН)2, кальцинированную соду Na2CO3, каустическую соду NaОН, аммиачную воду, а также фильтрование через нейтрализующие материалы природного происхождения: известняк СаСO3, доломит СаСO3×MgСO3 и др. При нейтрализации сточных вод, содержащих серную кислоту, её концентрация не должна превышать 1,5 г/л, так как при большей концентрации поверхность нейтрализующих материалов покрывается плотным слоем малорастворимого гипса СаSO4×2Н2O, и процесс нейтрализации прекращается. Для нейтрализации щелочных вод наиболее часто применяются серная Н2SO4, соляная НСl и азотная НNO3 кислоты. В ряде производств используют также выбросные газы, содержащие СO2, SO2, NO2, N2O3 и др., в частности, дымовые газы. При этом происходят нейтрализация сточных вод и одновременная очистка производственных газовых выбросов от токсичных компонентов, что характерно для ресурсосберегающей и малоотходной технологии. Преимуществом подобной технологии также является исключение кислот для нейтрализации и возможность создания бессточной системы водопотребления. Схема такого нейтрализатора с мешалкой представлена на рис. 6. Нейтрализация щелочных вод дымовыми газами использована в ряде производств, в том числе и асбестоцементном производстве.
|
|
|
Окисление и восстановление как метод очистки применяется для обезвреживания промышленных сточных вод от цианидов, сероводорода, сульфидов, соединений ртути, мышьяка, хрома. В процессе окисления токсичные загрязнения переходят в менее токсичные. В качестве окислителей обычно используют хлор Сl2, диоксид хлора СlO2, гипохлориты натрия NaClO и кальция Са(СlO)2, перманганат калия КМnO4, дихромат калия К2Сг2O7, пероксид водорода Н2O2 и др. При хлорировании водных растворов цианидов, отличающихся весьма высокой токсичностью, процесс проводят в щелочной среде (рН ≥ 9). Вначале цианиды переходят в цианаты:
CN─ + 2OН─ + Cl2 → CNO− + 2Cl─ + H2O,
а последние превращаются в молекулярный азот и диоксид углерода:
2CNO─ + 4OН─ + 3С12 → СО2↑ + 6С1─ + N2 ↑ + Н2O.
Аналогично протекает окисление цианидов в присутствии производных хлора – гипохлоритов натрия и кальция.
Озон, в силу своей высокой окислительной способности, уже при нормальной температуре разрушает многие органические компоненты сточных вод. Благодаря озонированию одновременно происходят обесцвечивание и обеззараживание сточной воды, а также насыщение её кислородом. Эффективность озонирования существенно повышается, а следовательно, сокращается и длительность процесса очистки, если совместно использовать ультразвук и озон или УФ-облучение и озон. Подобно хлору, озон энергично реагирует с цианидами в слабощелочной среде:
|
|
|
CN─ + O3 → CNO─ + O2↑,
2CN─ + H2O + 3O3 → 2HCO3─ + 3O2↑ + N2.
Методы восстановительной очистки сточных вод применимы в тех случаях, когда они содержат легко восстанавливаемые вещества, в частности, соединения ртути, хрома и мышьяка. При этом соединения ртути восстанавливают до металлической ртути, которую отделяют от воды отстаиванием или фильтрацией. Восстановителями служат сероводород, алюминиевая пудра, железный порошок, сульфид железа. Для восстановления шестивалентного хрома (Сr2O72─) используют сульфат железа (II), диоксид серы, водород, отходы органических веществ, например, газетную бумагу.
Ионы тяжёлых металлов: цинка, меди, ртути, кобальта, кадмия, никеля, мышьяка, свинца и хрома можно удалить из промышленных сточных вод, переводя их в малорастворимые соединения с последующим отделением осадка от воды. Осаждение проводят в виде гидроксидов, карбонатов или сульфидов, характеризующихся низкими значениями произведений растворимости. В качестве реагентов-окислителей применяют гидроксиды кальция и натрия, карбонат натрия, сульфид натрия. При добавлении к сточной воде Са(ОН)2 или NaOH образуются гидроксиды соответствующих тяжёлых металлов:
Men+ + n(OH)─ → Me(OH)n↓.
Значения рН, соответствующие началу и окончанию осаждения некоторых металлов, представлены в табл. 4.
Таблица 4
Величины рН осаждения гидроксидов металлов
| Вид катиона-загрязнителя | Начало осаждения при исходной концентрации осаждаемого иона 0,01 М | Полное осаждение |
| Fe2+ | 7,5 | 9,7 |
| Fe3+ | 2,3 | 4,1 |
| Zn2+ | 6,4 | 8,0 |
| Cr3+ | 4,9 | 6,8 |
| Ni2+ | 7,7 | 9,5 |
| Al3+ | 5,2 | |
| Cd2+ | 8,2 | 9,7 |
Примечание. Величина рН полного осаждения соответствует остаточной концентрации иона металла 10-5 М/л.
В случае использования реагентов, содержащих соду Na2CO3, тяжёлые металлы осаждаются не только в виде гидроксидов, но и в виде гидроксид-карбонатов. Например,
2ZnCl2 + 2Na2CO3 + H2O → 4NaCl + CO2↑ + (ZnOH)2CO3↓
2Cu2+ + CO32─ + 2OH─ → (CuOH)2CO3↓
2Ni2+ + CO32─ + 2OH─ → (NiOH)2CO3↓
Pb2+ + CO32─ + 2OH─ → (PbOH)2CO3↓.
|
|
|
В том случае, когда требуется более глубокая степень очистки сточных вод, тяжёлые металлы рекомендуется выделять в виде сульфидов:
Me2+ + S2─ → MeS↓,
растворимость которых ниже растворимости соответствующих гидроксидов.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 843; Нарушение авторских прав?; Мы поможем в написании вашей работы!