
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Атомная орбиталь 1s в атоме водовода
|
|
|
|
Волновая функция, описывающая состояние электрона в атоме, который характеризуется совокупностью квантовых чисел n, l, m, называется атомной орбиталью (АО):
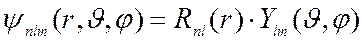 (5)
(5)
Для удобства ее рассматривают в сферических координатах (r,ϑ,φ).
Функция 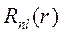 позволяет вычислить вероятность нахождения электрона в атоме в зависимости от расстояния от ядра (r),
позволяет вычислить вероятность нахождения электрона в атоме в зависимости от расстояния от ядра (r),
Фукция  позволяет вычислить вероятность нахождения электрона в атоме в зависимости от направления в системе коодинат.
позволяет вычислить вероятность нахождения электрона в атоме в зависимости от направления в системе коодинат.
Существует несколько видов волновой функции. Наиболее используемыми являются Гауссовы и Слейтеровские волновые функции:

Рассмотрим эти составляющие волновой функции и (5) на примере АО основного состояния 1s (n = 1, l = 0, m = 0):
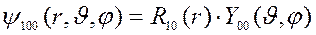
где
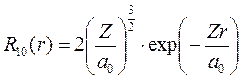
 ,
,
где Z – порядковый номер атома (количество протонов в ядре, для водорода Z=1), а0 – боровский радиус первой орбиты, для атома водорода а0=0,529Å.
Соответственно:
 и
и 
Тогда квадрат волновой функции для 1s обритали атома водорода:

Угловая фукция 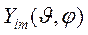 не зависит от координат (углов
не зависит от координат (углов 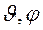 ), т.е. соответствует сферической симметрии. Это и определяет сферическую симметрию 1s обритали (любой ns орбитали!)
), т.е. соответствует сферической симметрии. Это и определяет сферическую симметрию 1s обритали (любой ns орбитали!)
Функция  и ее квадрат
и ее квадрат  - радиальная составляющая плотности вероятности - уменьшают свое значение экспоненциально с удалением от ядра. Поэтому на расстоянии 2-3 Å от ядра вероятность найти электрон очень мала. Если очертить вокруг ядра такую сферу, чтобы за ее пределами значение
- радиальная составляющая плотности вероятности - уменьшают свое значение экспоненциально с удалением от ядра. Поэтому на расстоянии 2-3 Å от ядра вероятность найти электрон очень мала. Если очертить вокруг ядра такую сферу, чтобы за ее пределами значение  не превосходило, например, 0,01 от ее максимального значения, мы получим «граничную поверхность» 1s АО.
не превосходило, например, 0,01 от ее максимального значения, мы получим «граничную поверхность» 1s АО.
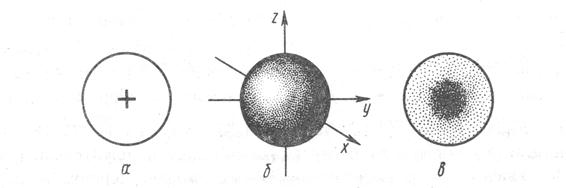
Рис. 5. Графическое представление волновой функции атомной s-орбитали: а) плоское сечение б) «граничная поверхность» s-орбитали в) распределение плотности заряда в состоянии 1s «электронное облако».
|
|
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 639; Нарушение авторских прав?; Мы поможем в написании вашей работы!