
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основы теории горения
|
|
|
|
Лекция №6
При горение:
1. Окислительные (прямые) реакции:
С + О2 = > СО2 + Q1↑
2Н2 + О2 = > 2Н2О + Q2↑
2. Восстановительные (обратные) реакции:
СО2 = > СО + О–Q3↑
H2O = > OH + OH–Q4↑
Различают горения:
1. гомогенное (горючие и окислитель в одном агрегатном состоянии);
2. гетерогенное (горючие и окислитель в разных агрегатных состояниях).
При гомогенном горении скорость реакции пропорциональна концентрации реагирующих веществ WP = kAmBn.
При гетерогенном горении скорость горения пропорциональна концентрации кислорода WP = kO2стенки.
k – константа скорость химической реакции.
k = k0e -E/RT
k0 характеризует максимальное число активных молекул в реакционном объеме
k0 = А
Е – энергия активации, которую необходимо сообщить системе для разрушения старых внутримолекулярных связей и образования активных осколков, дающих
начало новым реакциям.
Q = E1–Е
С + О2 = > СО2 + 140, 
СО + 0, 5О2 = СО + 60, 
 |
Е
 |  | ||
Е Е1


Е0
τ
Для воспламенения смеси ее необходимо нагреть для, того чтобы увеличить долю активных молекул, т.е. таких у которых энергия больше энергии активации.

- При Т = 0 к = 0;
- с ростом Т растет и к;
- при Т = ∞ к = к0.
Скорость реакции горения зависит:
 от Т
от Т
- от Е
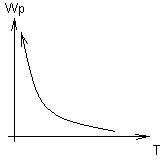
- от концентрационных свойств смеси
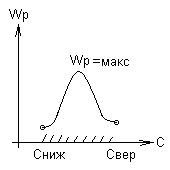
Температура воспламенения топливной смеси.
Это температура, при которой смесь воспламеняется и начинает устойчиво гореть.
В топке происходит два процесса:
- тепловыделение
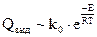
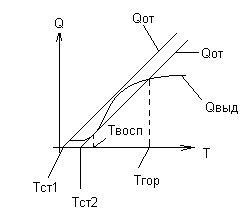
- Теплоотдача от факела к экрану
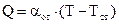
Для воспламенения необходимо, чтобы Qвыд > Qот
Твоспл зависит:
- от состава топлива;
- от условий расхолаживания топлива.
tвоспл = 225 – 250 – 400 – 900, ºС
|
|
|
Торф БУ КУ Антр
Области горения топлива.
Общее время горения складывается из двух стадий: продолжительность химических реакций и продолжительности физических процессов.
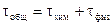
1. если продолжительность химических реакций много больше продолжительности физических процессов, то общее время горения равно
продолжительности химических реакций и горение происходит в кинетической области (зависит от температуры).
2. если продолжительность химических реакций много меньше продолжительности физических процессов, то общее время горения равно
продолжительности физических процессов и горение происходит в диффузионной области (определяется скоростью доставки окислителя).
3. если продолжительность химических реакций равна продолжительности физических процессов – промежуточная область.
Горение твердого топлива.

1. τтепл – время тепловой подготовки топлива. Оно включает в себя нагрев, испарение влаги и выход летучих веществ.
2. τгор включает в себя горение летучих веществ и горение коксового остатка.
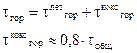
Механизм горения частиц.
Поверхность частицы адсорбирует кислород с образованием комплексов СхОу, которые генерируют СО и СО2.
 С + О2 = > СхОу = > mCO + nCO2.
С + О2 = > СхОу = > mCO + nCO2.
Соотношение СО и СО2 зависит от температуры.
1. при t = 1200ºС
4С + 3О2 = 2СО + 2СО2
Из области СО2макс часть СО2 возвращается к частице и раскисляется СО2 + С = 2СО
При малом расходе СО, О2 полностью не перехватываясь достигает поверхности частицы.
2. при t = 1700ºС 3С + 2О2 = 2СО + СО2

При высоком расходе СО, О2 расходуется полностью, не достигая поверхности частицы.
Скорость горения твердого топлива.


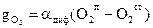
gO2 – расход окислителя,
αдиф – константа скорости диффузии.
Скорость реакции горения
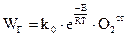
Если решить эти два уравнения относительно О2ст, то получаем скорость горения:
 , kГ – константа горения.
, kГ – константа горения.
|
|
|
1. при низких Т имеет место низкое значение k, значит
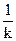 много больше
много больше  , поэтому
, поэтому  и WГ зависит от Т.
и WГ зависит от Т.
2. при высоких Т имеет место высокое значение k, а значит
 много больше
много больше 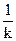 , поэтому
, поэтому  и WГ зависит от скорости подачи окислителя.
и WГ зависит от скорости подачи окислителя.
αдиф~ , где
, где 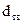 – размер частицы топлива.
– размер частицы топлива.
1.  область кинематического горения;
область кинематического горения;
2. промежуточная область.
3. область диффузионного горения;
Пути интенсификации горения.
- предварительное измельчение;
- интенсивное перемешивание в корне факела;
- эффективная доставка О2 к горючим в конце факела.
Горение жидкого топлива.
Мазут в факеле сгорает в виде капель при распылении форсунками.
Стадии горения:
1. нагрев до tкип ;
2. испарение топлива;
3. образование топливной смеси;
4. ее воспарение и сгорание.

1. капля;
2. зона диффузии паров;
3. зона диффузии кислорода;
4. зона горения;
5. r0 – начальный радиус капли;
6. rгор – радиус горения.
rгор = (4–10) r0
Время горения капли определяется временем ее испарения.
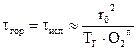
- при снижении r0, растет удельная наружная поверхность, а значит, растет теплота сгорания и снижается время испарения;
- с ростом ТГ, растет
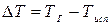 , а значит, растет теплота сгорания и снижается время испарения;
, а значит, растет теплота сгорания и снижается время испарения; - с ростом О2п, растет скорость горения, а значит, снижается время испарения.
За счет высокой теплоты сгорания QнР, мазут горит в диффузионной области.
Особенность:
При сжигании мазута имеет место термический крекинг (последовательное отщепление Н2 с образованием частиц сажи).
Недостатки сажеобразования:
· неполнота сгорания (0, 1-0, 3%);
· загрязнение окружающей среды;
· загрязнение поверхностей нагрева (снижается коэффициент теплопередачи k, поэтому снижается Qотд, а значит растет температура уходящих газов и снижается КПД котла).
Для исключения сажеобразования проводят окислительный крекинг при активном внедрении воздуха в корень факела. При этом кислород, разрывая зону горения, проникает в зону диффузии паров для насыщения углеводородов кислородом.
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 447; Нарушение авторских прав?; Мы поможем в написании вашей работы!