
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Белки эритроцитов
Ферменты плазмы крови
1) Секреторные – синтезируются в органах, но свое действие оказывают только в сосудистом русле. Например, ЛХАТ, ЛПЛ. ЛХАТ синтезируется в печени, катализирует эстерификацию холестерина в сосудистом русле. ЛПЛ синтезируется в клетках жировой и мышечной ткани, секретируется в кровь и участвует в гидролизе триацилглицеринов, входящих в состав липопротеинов.
2) Индикаторные – синтезируются и оказывают свое действие только в тканях. Появление их в крови говорит о повреждении клеток. Например, АсАТ, АлАТ.
3) Экскреторные – нормальные компоненты желчи, при желчнокаменной болезни попадают в кровь. Например, щелочная фосфатаза, лейцинаминопептидаза.
В плазме крови содержатся промежуточные и конечные продукты обмена белков. Это небелковые азотистые вещества: полипептиды, аминокислоты, мочевина, мочевая кислота, креатин, креатинин, пурины, пиримидины.
Среди безазотистых веществ в крови присутствуют продукты обмена углеводов и липидов: глюкоза, молочная и пировиноградная кислоты, жирные кислоты, глицерин, кетоновые тела.
Постоянными компонентами плазмы являются минеральные вещества: NaCl, КCl, CaCl2, MgCl2, NaHCO3, CaCO3, K2HPO4, Ca(PO4)2, Na2SO4, незначительные количества соединений Fe, Cu, Zn, I, Mn, Co.
Представлены гемоглобином и небольшим количеством белков стромы.
Различают два основных типа белков плазматической мембраны: поверхностные и интегральные. Поверхностные белки локализованы на внутренней цитоплазматической поверхности мембраны. К ним относятся глицеральдегид-3-фосфатдегидрогеназа, актин, спектрин. Цепи спектрина образуют разветвленную волокнистую сеть. Спектрин стабилизирует и регулирует вместе с актином форму мембраны эритроцитов, которая изменяется при прохождении клеток через капилляры.
Интегральные белки расположены внутри мембраны. Их можно отделить от мембраны только с помощью детергентов или органических растворителей. В мембране имеется анионный канал, делающий ее проницаемой для НСО3- и Сl- . Это димер белка и составляет ¼ общего количества белка в мембране. Этот канал имеет большое значение для транспорта СО2 эритроцитами, канал Na+K+ АТФ-азы.
Гемоглобин - основной белок эритроцитов. Это сложный Fe содержащий белок с м.м. 68000. Состоит из белковой части - глобина и простетической группы гема. Молекула имеет 4 субъединицы с М. м. 17 тыс. каждая. В состав субъединицы входит гем и одна полипептидная цепь.
В глобин входит 574 аминокислоты. Различают 2 α и 2 β цепи. α- цепь состоит из 141 аминокислоты, N концевая - валин, С - аргинин. β- цепь имеет 146 аминокислот, N концевая - валин, С - гистидин. Четвертичная структура гемоглобина состоит из 2-х α и 2-х β цепей:
α2 β2 . Это основной гемоглобин взрослого человека НbА1 (adultus).
Гемовые группы находятся на поверхности глобулы в особых карманах, образованных петлями полипептидной цепи. Глобин соединяется через имидазольное кольцо гистидина с гемом по 5 координационной связи железа.

 а) Гем б)
а) Гем б)
|
 | |||
|
Структура гема (а), структура активного центра дезоксигемоглобина (б), структура активного центра оксигемоглобина (в)
Атом железа может образовать шесть координационных связей. Четыре связи направлены к атомам азота пиррольных колец, оставшиеся две связи – перпендикулярно к плоскости порфиринового кольца по обе его стороны. Гемы расположены вблизи поверхности белковой глобулы в специальных карманах, образованных складками полипептидных цепей глобина. Гемоглобин при нормальном функционировании может находиться в одной из трех форм: феррогемоглобин (обычно называемый дезоксигемоглобином или просто гемоглобином), оксигемоглобин и ферригемоглобин (называемый также метгемоглобином). В феррогемоглобине железо находится в закисной форме Fe(II), одна из двух связей, перпендикулярных к плоскости порфиринового кольца, направлена к атому азота гистидинового остатка, а вторая связь свободна (рис. б). Кроме этого гистидинового остатка, называемого проксимальным (соседним), по другую сторону порфиринового кольца и на большем расстоянии от него находится другой гистидиновый остаток – дистальный гистидин, не связанный непосредственно с атомом железа. Взаимодействие молекулярного кислорода со свободным гемом приводит к необратимому окислению атома железа тема [Fe(II) Þ Fe(III); гем Þ гемин]. В дезоксигемоглобине глобин предохраняет железо гема от окисления.
Обратимое присоединение кислорода (оксигенация), позволяющее гемоглобину выполнять свою основную функцию переносчика, обеспечивается возможностью образовать прочные пятую и шестую координационные связи и перенести электрон на кислород не от железа (то есть окислить Fe2+), а от имидазольного кольца проксимального гистидина. Вместо молекулярного кислорода железо гема может присоединить окись углерода СО (угарный газ). Даже небольшие концентрации СО приводят к нарушению кислородпереносящей функции гемоглобина и отравлению угарным газом.
Выше было сказано, что одна молекула гемоглобина содержит четыре субъединицы и, следовательно четыре тема, каждый из которых может обратимо присоединить одну молекулу кислорода. Поэтому реакцию оксигенации можно разделить на четыре стадии:
Нb + О2 Û HbO2
НbО2 + О2 Û Hb(O2)2
Hb(O2)2 + О2 Û Hb(O2)3
Hb(O2)3 + О2 Û Hb(O2)4
Прежде чем рассмотреть эту главную функциональную реакцию гемоглобина более детально, необходимо сказать несколько слов о мышечном гемоглобине – миоглобине. Он содержит одну молекулу гема и одну полипептидную цепочку, состав и структура которой подобны составу и структуре b-субъединицы гемоглобина. Как и для гемоглобина, важнейшей функцией миоглобина является обратимое присоединение молекулярного кислорода. Эту функцию характеризует так называемая кривая оксигенации, связывающая степень насыщения гемоглобина кислородом (в процентах) с парциальным давлением последнего, р о2 (мм Hg).
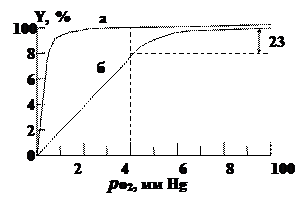 Типичные кривые оксигенации гемоглобина и миоглобина (при условии достижения химического равновесия) приведены на рис. Для миоглобина кривая является гиперболой, как и должно быть в случае одностадийной химической реакции при условии достижения химического равновесия:
Типичные кривые оксигенации гемоглобина и миоглобина (при условии достижения химического равновесия) приведены на рис. Для миоглобина кривая является гиперболой, как и должно быть в случае одностадийной химической реакции при условии достижения химического равновесия:
Кривые оксигенации миоглобина (а) и гемоглобина (б)
Совершенно другая картина возникает в случае гемоглобина. Кривая диссоциации имеет S-образную форму. Без кислорода молекулы гемоглобина обладают низким сродством к кислороду, затем кривая становится круче и при высоких значениях р О2 практически сливается с кривой диссоциации миоглобина.
Между гемами одной молекулы гемоглобина существует некоторая связь, благодаря которой присоединение кислорода к одному гему влияет на присоединение кислорода к другому гему той же молекулы. Это явление получило название гем-гем взаимодействия. Физиологический смысл гем-гем взаимодействия очевиден. Сигмоидная форма кривой диссоциации создает условия максимальной отдачи кислорода при переносе гемоглобина от легких с высоким значением р О2 к тканям с низким значением р О2. Для человека значения р О2 артериальной и венозной крови в нормальных условиях (Т 37°С, рН 7,4) равны соответственно 100 и 40 ммНg. При этом (рис. б) гемоглобин отдает тканям 23% связанного кислорода (степень оксигенации меняется от 98 до 75%). При отсутствии гем-гем взаимодействия для одногемового миоглобина (рис. а) эта величина не превышает 5%. Миоглобин поэтому служит не переносчиком, а депо кислорода и отдает его мышечной ткани лишь при резкой гипоксии, когда насыщение ткани кислородом падает до недопустимо низкого значения.
|
Дата добавления: 2014-01-20; Просмотров: 4306; Нарушение авторских прав?; Мы поможем в написании вашей работы!