
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиты и неэлектролиты
|
|
|
|
По способности проводить электрический ток все вещества подразделяются на: проводники и диэлектрики (изоляторы). Проводники I рода (металлы) характеризуются электронной проводимостью. Проводники II рода (электролиты) характеризуются ионной проводимостью.
Электролитами называются вещества, растворы или расплавы которых проводят электрический ток. (кислоты, основания, соли); Неэлектролиты - не проводят электрический ток. Это вещества с ковалентными неполярными или малополярными связями.[газы (азот, кислород), некоторые твердые вещества (сера, кремний), органические соединения (сахароза, бензол, спирт)].
Электролитическая диссоциация - это процесс распада вещества на ионы, происходящий под действием полярных молекул растворителя.
Основные положения теории электролитической диссоциации (С. Аррениус, 1887г.):
· При растворении в воде (или в расплаве) электролиты распадаются на положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
· Ионы в растворах сольватированы (гидратированы)AnBm + aq D nAm+∙ aq + mBn-∙ aq
· Под действием электрического тока катионы (+) движутся к катоду (-), а анионы (-) – к аноду (+).
· Электролитическая диссоциация - процесс обратимый (обратная реакция называется моляризацией, прямая - диссоциацией).AnBm ↔ nAm+ + mBn-
Кислоты – сложные вещества, диссоциирующие на катионы водорода и анионы кислотного остатка. HCl D H+ + Cl- фактически: HCl + H2O D H3O + + Cl-, где H3O + - ион оксония (гидроксония)
Основания – сложные вещества, диссоциирующие на анионы гидроксила и катионы металла.
Ва(OH)2 D Ba2+ + 2OH-
Соли – сложные вещества, диссоциирующие на катионы металла и анионы кислотного остатка.
Al2(SO4)3 D 2Al3+ + 3SO42-
|
|
|
Амфотерные электролиты (Be(OH)2, Zn(OH)2, Al(OH)3, Cr(OH)3, Pb(OH)2 и др.) - дисоциируют как по типу основания, так и по типу кислоты.
| в кислой среде в щелочной среде Zn2++ 2OH- D Zn(OH)2 D ZnO22-+2Н+ Н2ZnO2 | Zn(OH)2 + 2HCl = ZnCl2 + 2H2O Zn(OH)2 + 2NaOHтв. = Na2ZnO2 + 2H20 при сплавлении |
Количественные хар-ки проц-а диссоциации:
1.) Степень электролитической диссоциации (α) показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул растворенного вещества в растворе (N). α=n/N, 0< α <1
Электролиты: слабые ( α<3% ), средние (3%< α<30% ), сильные ( α> 30% )
К слабымым электролитам относятся вещества с неполярными или слабо полярными связями.
(H2O, H2CO3, Fe(OH)3); К сильным электролитам относятся вещества с ионными или сильно полярными связями (кис-ты HCl,HBr,HI,HClO4,H2SO4,HNO3,HMnO4,HCrO4, растворимые в воде основания LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2,Sr(OH)2) NH4OH – слабый электролит!
Степень диссоциации зависит: от природы электролита (I ступень: КНСО3 D К+ + НСО3-
II cтупень: НСО3 - D Н+ + СО32-);от природы растворителя (закон Кулона с учетом ε);
от температуры (с возрастанием температуры диссоциация увеличивается); от концентрации
(с увеличением разбавления диссоциация увеличивается).
| Сила кислоты или основания | Значение константы диссоциации |
| Сильные Средней силы Слабые Очень слабые | >1 1 – 10-4 10-4 - 10-10 < 10-10 |
2.) Константа диссоциации - константа равновесия процесса диссоциации, не зависит от концентрации. Чем больше константа диссоциации электролита, тем он сильнее.
Ступенчатая диссоциация: Многоосновные кислоты, многокислотные основания, кислые и основные соли диссоциируют ступенчато и каждая ступень характеризуется собственным значением константы диссоциации. К1> К2 > К3
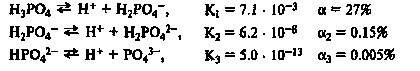
|
Закон разбавления Оствальда:
Кд=С* α^2
AgNO3 + HCl → AgCl↓ + HNO3
Ag+ + Cl- → AgCl↓
Для описания реальных св-в сильных электролитов исп. понятие эффективной (кажущейся) концентра-ции или активности: а = с ∙ f, а – активность, f – коэф. активности. В сильно разб. р-рах: f ≈ 1 и а ≈ с.
|
|
|
Условия необратимости реакций ионного обмена: образуется осадок Ba(OH)2 + Na2SO4 → BaSO4 ↓ + 2NaOH; выделяется газ CaCO3 + 2HCl → CaCl2 + H20 + CO2↑; образуется вода или другой слабый электролит 2KCN + H2SO4 → K2SO4 + 2HCN
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 5337; Нарушение авторских прав?; Мы поможем в написании вашей работы!