
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролитическая диссоциация воды, pH
|
|
|
|
Вода слабый электролит: Н20 D Н+ + ОН-; ее константа диссоциации при 298 K равна:
Кд=([H+]*[OH-])/[H2O] =1,8*10-16. При столь малой константе диссоциации концентрация воды остается практически неизменной и равной: [H2O]= 1000/18 = 55,6 моль*л-1.
Ионное произведение воды — произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водных растворах Kв = K д ∙ [H2O] = [H+]∙[OH–] = const = (1000*1,8*10-16)/18 =1*10-14
Реакция среды: Н20 D Н+ + ОН-; [H+] = [OH–] =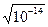 = 1 ∙ 10 –7 равенство [H+] и [OH–] соответствует нейтральной среде.
= 1 ∙ 10 –7 равенство [H+] и [OH–] соответствует нейтральной среде.
| в р-ре кис-ы (кислая среда) [H+] > 1 ∙ 10 –7 [OH–] < 1 ∙ 10 –7 | В р-ре щелочи (щелочная среда) [OH–] > 1 ∙ 10 –7 [H+] < 1 ∙ 10 –7 |
Для определения кислотно-
основных свойств растворов пользуются понятиями:
Водородный показатель это десятичный логарифм концентрации водородных ионов с обратным знаком: pH = –lg [H+]; Гидроксильный показатель среды pОH – это десятичный логарифм концентрации ионов гидроксила с обратным знаком: pОH = –lg [ОH-];
pH + pOH = –lg ([H+] ∙ [OH–]) = – lg 1 ∙ 10–14 =14; pH < 7 кислая, pH > 7 щелочная, pH = 7 нейтральная среда.
Индикаторы – вещества, меняющие свою окраску в зависимости от реакции среды.
Потенциометрия –это электрохимический метод анализа, основанный на зависимости величины электродного потенциала, а, следовательно, и ЭДС, составленного из соответствующих электродов гальванического элемента, от состава раствора. Для определения величины рН среды применяются рН-индикаторные электроды. Потенциал стеклянного электрода зависит от концентрации (активности) ионов водорода в растворе.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 540; Нарушение авторских прав?; Мы поможем в написании вашей работы!