
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общие сведения о строении ферментов
|
|
|
|
По строению ферменты делятся на две группы:
1. однокомпонентные ферменты, представляющие собой простые белки;
2. двух- или многокомпонентные ферменты – сложные белки (протеиды).
К однокомпонентным ферментам, состоящим только из аминокислот, относятся многие гидролазы: трипсин, пепсин, рибонуклеаза, уреаза и др.
К многокомпонентным ферментам относятся такие, в состав которых кроме белкового компонента входит небелковая часть – кофермент, или ион металла – кофактор, или и то и другое вместе.
Ферменты относятся к глобулярным белкам, форма их молекул близка к сферической, а молекулярная масса колеблется в широких пределах: от 14 до 1000 кДа. Для каждого фермента характерны первичная, вторичная и третичная структуры апофермента, отличающие его от всех других ферментов.
Сворачивание молекул глобулярных белков происходит таким образом, что в ядре глобулы располагаются в основном гидрофобные участки полипептидной цепи, а на поверхности располагаются как гидрофильные, так и гидрофобные элементы. Образование такой мозаичной поверхности ограничивает размеры глобулы, поскольку с увеличением ее объема труднее сформировать достаточно гидрофобное ядро и достаточно гидрофильную поверхность. Это ограничение приводит к тому, что начиная примерно с молекулярной массы 14-16 кДа полипептидная цепь формирует два или более домена. Доменами называют независимо сформированные в пространстве структурные фрагменты молекулы белка, т.е. области в третичной структуре белка с определенной структурной автономией. Таким образом домены составляют подуровень структурной организации белка на пути от вторичной к третичной структуре
Представление о пространственной организации белковой цепи не только в виде цельной компактной глобулы, но и в форме нескольких слабо связанных между собой глобулярных областей неоднократно высказывалось рядом авторов. Так, доменная организация трехмерной структуры α-химотрипсина была отмечена в 1972 году Дж. Бирктофтом и Д. Блоу. в 1996 году Д. Филлипс при анализе кристаллографической структуры лизоцима пришел к выводу о наличии в его структуре нескольких компактных глобулярных доменов.
|
|
|
Было установлено, что нативная (от английского native – природный) конформация трипсина, пепсина, папаина и других гидролаз включает два домена.
Четкой корреляции между доменной организацией и размером белка не существует. Например, молекула бактериохлорофилла (330 аминокислот) представляет собой цельную глобулу, а лизоцим (129 аминокислот) состоит из двух доменов. Отсутствует также какая-либо связь между доменной организацией и содержанием в белке вторичных структур. Известны домены, в которых α-спирали и складчатые листы составляют около 50% (термолизин), и домены, в которых они вообще отсутствуют (тРНК-синтетазы).
Играют ли домены какую-либо функциональную роль в проявлении каталитической активности ферментов?
Наличие доменов создает структурные предпосылки для большей внутренней гибкости белковых молекул, достигаемой смещением доменов относительно друг друга. Часто отдельные домены ответственны за определенные виды взаимодействий фермента с субстратом и эффекторами. Эффекторами называют вещества, которые оказывают влияние на активность ферментов.
Например, нуклеотид-связывающий домен дегидрогеназ, имеющий независимо от конкретной функции того или иного фермента одинаковый способ укладки полипептидной цепи, ответствен за взаимодействие с коферментом NAD+ или NADH.
Однако в ряде случаев для доменов нельзя указать отдельной функциональной роли. Например, в структуре папаина хорошо различимы два домена. Во впадине, разделяющей домены, расположен каталитический центр, причем образующие его функциональные группы размещены в обоих доменах (Cys-25, His-159, Asn-175).
|
|
|
Часто макромолекула фермента состоит из нескольких субъединиц. Субъединицы могут представлены одинаковыми или разными полипептидами. Для таких ферментов характерной является также четвертичная структура. Например, активной формой лактатдегидрогеназы является тетрамер с молекулярной массой 144 кДа. Каждая субъединица образована полипептидной цепью из 334 аминокислот и имеет молекулярную массу 36 кДа
В отличие от всех других белков ферменты имеют в своей структуре особый участок – активный центр. Под активным центром понимают ту часть молекулы фермента, к которой присоединяется субстрат. Кофермент, как правило, входит в состав активного центра фермента.
В его пределах различают адсорбционный участок и каталитический участок. Кроме того, вне активного центра фермента встречаются особые функциональные участки; каждый из них обозначают термином аллостерический центр.
Активный центр фермента образуется на уровне третичной структуры белка из остатков аминокислот, находящихся в составе различных участков полипептидной цепи или различных полипептидных цепей, пространственно сближенных. Каталитический участок активного центра следующими функциональными группами, входящими в остатки аминокислот:
Функциональные группы и Аминокислоты каталитического участка
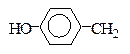 |
НО- серин треонин тирозин
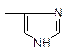 НS- цистеин ‾ООС- аспарагиновая и глутаминовая кислоты
НS- цистеин ‾ООС- аспарагиновая и глутаминовая кислоты
Гистидин СONH2 Глутамин, аспарагин
NHC(NH2)2+ аргинин NH3+ лизин
В формировании адсобционного участка активного центра могут участвовать остатки любых аминокислот.
Каталитический центр - это та область (зона) активного центра фермента, которая непосредственно участвует в химических преобразованиях субстрата. Формируется он за счет радикалов двух, иногда трех аминокислот, расположенных в разных местах полипептидной цепи фермента, но пространственно сближенных между собой за счет изгибов этой цепи. Например, каталитический центр "серин-гистидиновых" ферментов формируется за счет радикалов аминокислот серина и гистидина. Если фермент является сложным белком, то в формировании каталитического центра участвует также простетическая группа молекулы фермента (кофермент). Коферменты образуются в организме из витаминов, некоторые витамины непостредственно являются коферментами (аскорбиновая кислота, витамин К)
|
|
|
Адсорбционный центр - это участок активного центра молекулы фермента, на котором происходит сорбция (связывание) молекулы субстрата. Он формируется одним, двумя, чаще тремя радикалами аминокислот, которые обычно расположены рядом с каталитическим центром. Главная его функция - связывание молекулы субстрата и передача этой молекулы каталитическому центру в наиболее удобном положении (для каталитического центра). Эта сорбция происходит только за счет слабых типов связей и потому является обратимой. По мере формирования этих связей происходит конформационная перестройка адсорбционного центра, которая приводит к более тесному сближению субстрата и активного центра фермента, более точному соответствию между их пространственными конфигурациями. Такое соответствие - не заранее "готовое", а формирующееся в ходе взаимодействия - американский ученый Кошленд положил в основу теории индуцированного соответствия (или наведенного соответствия), которая преодолела ограниченность существовавшей ранее теории ключа и замка (жесткого соответствия структуры субстрата структуре адсорбционного центра).
Очевидно, что именно структура адсорбционного центра определяет субстратную специфичность фермента, т. е. требования фермента к молекуле химического вещества, чтобы она могла стать для него подходящим субстратом.
Четвертичная структура белков имеет, по-видимому, отношение и к существованию изоферментов. Изоферментами называются ферменты, встречающиеся у одного и того же биологического вида в разных структурных формах. Существование изоферментов возможно только в том случае, если ферментный комплекс состоит из нескольких различных субъединиц.
|
|
|
В качестве примера рассмотрим фермент лактатдегидрогеназу (ЛДГ). Активной формой лактатдегидрогеназы является тетрамер из четырех субъединиц. В тетрамере субъединицы занимают эквивалентные положения; каждый мономер содержит активный центр.
 В организме млекопитающих имеются два различных типа субъединиц ЛДГ (Н и М), незначительно различающихся по первичной структуре. Они могут случайным образом участвовать в образовании тетрамера. Известно 5 различных изоферментов ЛДГ, а именно НННН, МННН, ММНН, МММН и ММММ. В мышцах сердца содержатся тетрамеры ЛДГ, преимущественно состоящие из Н-субъединиц, а в печени и скелетных мышцах – из М-мономеров.
В организме млекопитающих имеются два различных типа субъединиц ЛДГ (Н и М), незначительно различающихся по первичной структуре. Они могут случайным образом участвовать в образовании тетрамера. Известно 5 различных изоферментов ЛДГ, а именно НННН, МННН, ММНН, МММН и ММММ. В мышцах сердца содержатся тетрамеры ЛДГ, преимущественно состоящие из Н-субъединиц, а в печени и скелетных мышцах – из М-мономеров.
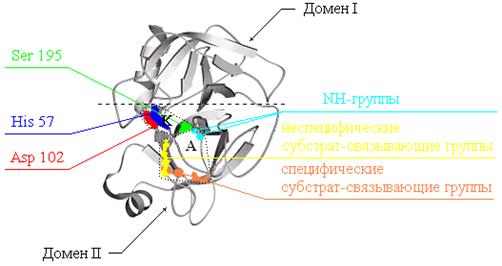
Рис. 1.1. Положение и строение активного центра в молекуле трипсина.
Размер активного центра по сравнению с размером молекулы увеличен примерно в 100 раз. Пунктиром показаны: К – каталитический участок, сформированный гидроксигруппой серина, имидазольным кольцом гистидина и карбоксилатной группой аспарагиновой кислоты; А – адсорбционный участок, включающий липофильные группы и группы, участвующие в образовании водородных связей и диполь-дипольном взаимодействии с субстратом. Ровная пунктирная линия отделяет два домена
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 1383; Нарушение авторских прав?; Мы поможем в написании вашей работы!