
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз
|
|
|
|
Li Rb K Ba Ca Na Mg Al Mn Zn Cr Fe Co Pb H Cu Hg Ag Pt Au
Чем левее находится металл в ряду, тем сильнее выражены его восстановительные свойства. Металлы, стоящие левее водорода – восстанавливают ионы водорода до молекулярного водорода, а металлы, стоящие справа от водорода – наоборот, являются более сильными окислителями. Этот ряд важен для предсказания многих свойств металлов: вытеснения металлов из солей, взаимодействие с кислотами, электролиз растворов солей и пр.
Стандартные электродные потенциалы существуют не только для металлов, но и для неметаллических систем. Чем больше значение потенциала, тем сильнее окислитель.
Важнейшие окислители и восстановители приведены в таблице.
| Окислители | Восстановители |
| Галогены F2, Cl2, Br2, I2. Окислительная способность уменьшается от F2 к I2. Кислород и озон (О2 и О3) Кислоты-окислители (HNO3, H2SO4(конц)) Соли, содержащие элемент с высокой степенью окисления (KMnO4, K2Cr2O7, KClO3) Анод при электролизе | Металлы Водородные соединения NH3, PH3, CH4 и др. Ионы металлов, в низших степенях окисления (Fe2+, Cr2+, Sn2+) Органические вещества Катод при электролизе |
Однако, существуют вещества, которые могут быть как окислителями, так и восстановителями. Обычно эти вещества содержат элементы в промежуточной степени окисления: Н2О2, SO2, HNO2.
В случае протекания окислительно-восстановительной реакции в растворе, важную роль играет кислотность среды. В частности, значения рН определяет формы существования продуктов реакции:
| Исходное вещество | рН среды | Продукт реакции |
| KMnO4 (малиновый раствор, темно-фиолетовые кристаллы с мет.блеском) | pН<7 кислая | Mn2+ (бесцветный раствор) |
| рН = 7 нейтральная | MnO2 (черный или коричн. осадок) | |
| pН >7 щелочная | MnO42¯ (темно-зеленый раствор) | |
| K2Cr2O7 (оранжев.) K2Cr2O7или K2CrO4 K2CrO4 (желтый) | pН<7 кислая | Cr3+ (зеленый или фиолетовый раствор) |
| рН = 7 нейтральная | Сr(OH)3 (серо-зеленый осадок) | |
| pН >7 щелочная | [Cr(OH)6]3¯ (зеленый раствор) |
|
|
|
Электролиз – окислительно-восстановительный процесс, происходящий при прохождении электрического тока через раствор или расплав электролита.
Электролиз водных растворов:
При определении продуктов следует помнить, что
1. На катоде восстанавливающийся продукт зависит от положения металла в ряду стандартных элеткродных потенциалов
Li Rb K Ba Ca Na Mg Al | Mn Zn Cr Fe Co Pb H | Cu Hg Ag Pt Au
В растворах солей металлов первой группы восстанавливается только водород.
В растворах солей металлов второй группы параллельно протекает два процесса – восстановления водорода и металла. (В задачах часто имеется в виду, что восстанавливается только катионы металла, а восстановление водорода в данном случае не рассматривают.) При электрлизе растворов солей металлов третьей группы на катоде восстанавливается только металл.
2. На аноде получающийся продукт зависит как от материала анода, так и от природы аниона. На инертном электроде окисляются Cl¯, Br¯, I¯, S2¯ (анионы бескислородных кислот), OH¯ и RCOO¯ (анионы карбоновых кислот до R2 + 2CO2). F¯ и анионы кислородсодержащих кислот (сульфат, нитрат, фосфат-анионы) не подвержены электролизу в водных растворах.
Взаимосвязь между количеством вещества, образовавшегося при электролизе на электроде (катоде или аноде), и количеством электричества, прошедшим через электрическую ячейку, определяется законом Фарадея:
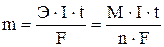
m – масса выделившегося вещества (г);
Э – эквивалентная масса вещества (г/моль), равная отношению молярной массы на количество отдаваемых или принимаемых электронов;
|
|
|
M – молярная масса выделившегося вещества (г/моль);
n – число электронов, принимающих участие в данной реакции;
I – сила тока (А); t – время (c); F - постоянная Фарадея = 96500 Кл/моль.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 1168; Нарушение авторских прав?; Мы поможем в написании вашей работы!