
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение изотермы химической реакции
|
|
|
|
Рассмотрим условную реакцию, протекающую в идеальной газовой фазе при p, T = const:
а А + b В = e Е + l L.
Пусть в реакцию вступило бесконечно малое количество вещества А(dn A моль); с ним прореагировало dn B моль вещества Ви образовалось dn E моль вещества Eи dn L моль L. Изменения количества исходных веществ и продуктов реакции составили: – dn A, – dn B (количество исходных веществ уменьшается, поэтому знак «–»), dn E и dn L.
В результате этого самопроизвольного процесса изобарный потенциал системы G изменился на величину
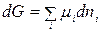 ,
,
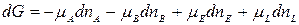 . (1)
. (1)
Выразим dn A, dn B, dn E, и dn L через коэффициенты уравнения реакции. Согласно уравнению:
с а моль вещества А реагирует b моль вещества В
с dn Aмоль dn B,
тогда
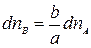 .
.
Аналогично,
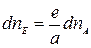 ;
; 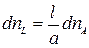 .
.
Подставим в (1):
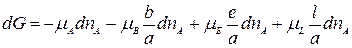 .
.
Умножим левую и правую часть уравнения на а и разделим на dnA:
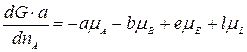 .
.
Так как химический потенциал равен мольной энергии Гиббса 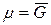 , то
, то
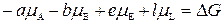 . (2)
. (2)
Применим выражение для химического потенциала компонента идеальной газовой смеси:
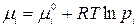 .
.
Химический потенциал вещества А равен
 ,
,
и т.д. для других компонентов.
Подставим в (2):
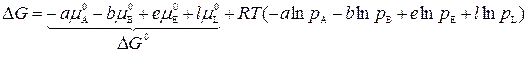 ,
,
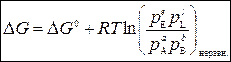 , (3)
, (3)
где 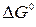 – изменение энергии Гиббса в стандартных условиях (при p = 1 атм и
– изменение энергии Гиббса в стандартных условиях (при p = 1 атм и
Т = const), зависит только от природы участников реакции и температуры; p E, p L, p A, p B – рабочие (еще неравновесные) парциальные давления компонентов в реакторе.
Уравнение (3) – уравнение изотермы химической реакции.
При равновесии Δ G = 0, парциальные давления компонентов становятся равновесными и из уравнения изотермы (3) следует, что
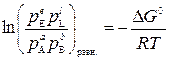 . (4)
. (4)
Так как правая часть уравнения (4) зависит только от температуры и природы реагентов, то и левая часть есть постоянная величина при Т = const.
Введем обозначение:
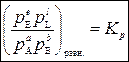 , (5)
, (5)
где Кр – термодинамическая константа равновесия. Нижний индекс «р» означает, что константа равновесия выражена через парциальные давления компонентов.
|
|
|
Уравнение (5) выражает известный закон действия масс: отношение произведения равновесных парциальных давлений продуктов реакции, взятых в степенях, равных стехиометрическим коэффициентам к аналогичному произведению для исходных веществ при данной температуре есть величина постоянная.
Тогда
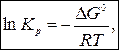
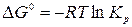 .
.
Подставим в (3):
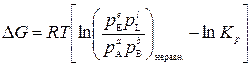 . (6)
. (6)
Если известна константа равновесия реакции и парциальные давления (или концентрации) реагентов с помощью уравнения (6) можно оценить знак D G и сделать вывод о направлении самопроизвольного процесса: реакция будет протекать самопроизвольно, если
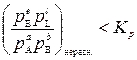 ,
,
т.к. при этом D G < 0.
В зависимости от вида системы, в которой протекает реакция (идеальная, реальная) константу равновесия выражают через парциальные давления Kp, концентрации Kc, мольные доли Kx, активности Ka, фугитивности Kf:
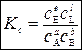 ,
,  и т.п.
и т.п.
Парциальное давление газа pi связано с его мольной долей xi и молярной концентрацией ci соотношением
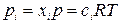 ,
,
где p – общее давление реакционной смеси, p = S pi.
Тогда
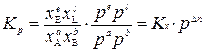 ,
,
где D n = e + l – (a + b) – разность между стехиометрическими коэффициентами газообразных продуктов реакции и исходных веществ.
Аналогично,
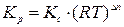 .
.
Таким образом,
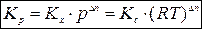 .
.
Если D n = 0, то
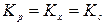 .
.
Kp, Kc = f(T), а Kx = f(T, p).
Если химическая реакция протекает с участием конденсированных веществ (твердых или жидких), то закон действия масс записывается только для газообразных участников реакции. Например, для реакции
СаСО3(тв) = СаО(тв) + СО2(г)
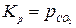 .
.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 460; Нарушение авторских прав?; Мы поможем в написании вашей работы!