
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константа диссоциации. Особенности диссоциации слабых электролитов
|
|
|
|
Особенности диссоциации слабых электролитов.
Сильные и слабые электролиты
Свойства растворов электролитов
· Электролитами называют вещества, растворы (или расплавы) которых проводят электрический ток.
Причиной электропроводности растворов электролитов является
· электролитическая диссоциация – процесс самопроизвольного распада растворённого вещества на ионы (положительные – катионы и отрицательные – анионы).
Количественно процесс диссоциации характеризуют степенью диссоциации.
· Степень диссоциации (a) – отношение количества вещества, распавшегося на ионы, к общему количеству растворенного вещества.
Выражают степень диссоциации в долях единицы или в процентах. Степень диссоциации зависит от природы растворенного вещества и растворителя, от температуры и концентрации раствора.
Наибольшей степенью диссоциации характеризуются вещества с ионной связью. Так при растворении кристаллов хлорида натрия в воде под действием полярных молекул растворителя ослабляются связи в кристалле, и частицы переходят в раствор с образованием гидратированных ионов:
NaCl + nH2O = Na+(H2O)x + Cl-(H2O)n-x.
Чем полярнее молекулы растворителя, тем выше степень диссоциации растворённого вещества. Например, NaCl не диссоциирует в неполярном растворителе – бензоле.
Диссоциация большинства соединений – эндотермический процесс, поэтому с повышением температуры согласно принципу Ле Шателье степень диссоциации увеличивается (за редкими исключениями).
Степень диссоциации также возрастает при разбавлении раствора (понижении концентрации), так при понижении концентрации раствора уксусной кислоты от 0,1М до 0,001М степень диссоциации увеличивается от 1,4 до 12,4%.
|
|
|
В зависимости от степени диссоциации в водном раст-воре все электролиты можно разделить на сильные и слабые.
Сильные электролиты в водном растворе полностью диссоциированы на ионы, слабые диссоциированы частично.
· Сильные электролиты:
· все соли;
· многие неорганические кислоты: HNO3, H2SO4, HCl, HBr, HI, HMnO4, HClO4 и другие;
· основания – гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
В уравнениях диссоциации сильных электролитов пишут знак равенства:
Al2(SO4)3 = 2Al3+ + 3SO42-;
HNO3 = H+ + NO3-;
Ca(OH)2 = Ca2+ + 2OH-.
· Слабые электролиты:
· некоторые неорганические и большинство органических кислот – H2CO3, H2SiO3, HNO2, H3PO4, H2SO3, H2S, HF, HCN, CH3COOH и другие;
· основания (кроме гидроксидов щелочных и щелочноземельных металлов) и амфотерные гидроксиды. Гидроксид аммония NH4OH – также слабый электролит.
В растворах слабых электролитов устанавливается динамическое равновесие между ионами и недиссоциированными молекулами, условно:
AB <==> A+ + B-
Константу равновесия при диссоциации называют константой диссоциации ( ):
):
 ,
,
где  ,
,  - равновесные концентрации ионов, моль/л;
- равновесные концентрации ионов, моль/л;
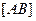 - равновесная концентрация недиссоциированных молекул, моль/л.
- равновесная концентрация недиссоциированных молекул, моль/л.
Константа диссоциации, так же как и степень диссоциации, зависит от природы растворённого вещества и растворителя, от температуры. Константа диссоциации, как и любая константа равновесия, не зависит от концентрации раствора. Чем слабее электролит, тем меньше константа диссоциации. Значения констант диссоциации слабых электролитов при 298 К приведены в справочниках, в дальнейшем при использовании справочных значений констант диссоциации температуру указывать не будем.
Рассмотрим примеры уравнений, описывающих диссоциацию некоторых слабых электролитов в водных растворах.
· Диссоциация слабых кислот.
Кислоты диссоциируют с образованием ионов водорода. Процессу диссоциации слабой уксусной кислоты соответствует уравнение
|
|
|
CH3COOH <==> H+ + CH3COO-,
 .
.
Многоосновные кислоты диссоциируют ступенчато. Число ступеней диссоциации равно основности кислоты. Так, процесс диссоциации двухосновной сероводородной кислоты характеризуют двумя ступенями.
Первую ступень диссоциации описывают уравнением:
H2S <==> H+ + HS-,
константа диссоциации по первой ступени:
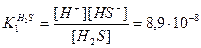 .
.
Уравнение диссоциации по второй ступени:
HS- <==> H+ + S2-,
константа диссоциации по второй ступени:
 .
.
Диссоциация по первой ступени проходит в большей степени, чем по второй, 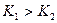 . Это справедливо для процесса диссоциации большинства слабых электролитов. Ион от нейтральной частицы (молекулы) при диссоциации по первой ступени отрывается легче, чем от противоположно заряженных ионов при диссоциации по последующим ступеням.
. Это справедливо для процесса диссоциации большинства слабых электролитов. Ион от нейтральной частицы (молекулы) при диссоциации по первой ступени отрывается легче, чем от противоположно заряженных ионов при диссоциации по последующим ступеням.
Образованием при диссоциации многоосновных кислот сложных ионов объясняется существование кислых солей (NaHS, KHCO3, CaHPO4 и др.).
· Диссоциация слабых оснований.
Основания диссоциируют с образованием гидроксид-ионов OH-. Слабые основания, содержащие несколько гидроксид-ионов, диссоциируют по ступеням, например:
Fe(OH)2 <==> FeOH+ + OH-, 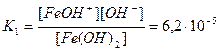 ;
;
FeOH+ <==> Fe2+ + OH-,  .
.
Образованием при диссоциации сложных ионов объясняется существование основных солей (FeOHCl, (CuOH)2CO3 и др.)
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 3458; Нарушение авторских прав?; Мы поможем в написании вашей работы!