
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способность к прядению и текстурированию
Реологические свойства.
Гелеобразующая способность.
Это способность коллоидных растворов белков переходить из свободно диспергированного состояния в связнодисперсное.
Хороший белок-гелеобразователь должен:
– образовывать гели в широком диапазоне рН при минимальной концентрации;
– обладать такими физико-химическими свойствами как прочность, твёрдость, эластичность, тиксотропия (способность обратимо переходить в текучее состояние при механическом воздействии и вновь образовывать нетекучий гель после снятия нагрузки);
– обладать оптимальной температурой размягчения и плавления, оптимальной степенью набухания, способностью к синерезису (к отделению дисперсионной среды с сокращением объёма геля), способностью к сорбции красителей и ароматических веществ и др.
Таким универсальным гелеобразователем является желатин.
5. Плёнкообразующая способность, адгезионные свойства.
Способность белковых суспензий к адгезии — сцеплению с поверхностями металлов, пластмасс, картона, бумаги — важна в процессах транспортировки, формования и упаковки теста, творога, сыров, конфет, мясных и рыбных фаршей, текстуратов и аналогов белка.
Это вязко-эластично-упругие свойства. Ими обладают белки клейковины пшеницы, обуславливающие текстуру хлеба и создающие непрерывную фазу в изделиях с наполнителями (отрубями, изюмом и т.п.). За реологические свойства отвечает глютениновая фракция клейковины.
С целью улучшения качества и расширения ассортимента пищевых изделий осуществляют регулирование функциональных свойств белков.
Широко используемыми методами такого регулирования являются физико-химичес-кие и ферментативные. К физико-химическим методам относятся: растворение белков перед сушкой в растворе кислот или щелочей с целью изменения их заряда или ионного состава, термоденатурация и др. При этом у белков повышается растворимость, гелеобразующая, жироэмульгирующая способности, способность к текстурированию и прядению.
Также проводят ферментативную модификацию функциональных свойств белков, для чего используют протеазы. Преимуществами получения таких белков являются мягкие режимы выделения, сохранение биологической ценности, возможность регулирования степени гидролиза и т.д.
Превращения белков в технологическом потоке
Любое изменение условий среды в технологических потоках производства пищевых продуктов оказывает влияние на нековалентные связи в белковых молекулах и приводит к разрушению их четвертичной, третичной и вторичной структур, т.е. к денатурации белков.
Большинство белков денатурирует в присутствии сильных минеральных кислот или щелочей, при нагревании, охлаждении, обработке ПАВами, мочевиной, тяжёлыми металлами (Ag, Pb, Hg) или органическими растворителями (этанолом, ацетоном).
Бóльшая часть белков денатурирует при 60–80 °С. Однако встречаются и термостабильные белки, например α-лактоглобулин молока и бактериальные α-амилазы. Повышенная устойчивость некоторых белков к нагреванию часто обуславливается наличием в их составе большого количества дисульфидных (–S–S–) связей.
Степень тепловой денатурации белков зависит от их влажности, рН и солевого состава среды, присутствия небелковых соединений. Например, температура денатурации белков сои и подсолнечника существенно понижается в присутствии жирных кислот, в кислой и влажной среде, но повышается в присутствии сахарозы и крахмала.
Тепловая денатурация лежит в основе выпечки хлеба, печенья, бисквитов, пирожных, сухарей, сушки макаронных изделий, варки, жарения овощей, рыбы, мяса, консервирования, пастеризации и стерилизации молока.
Денатурированные белки обычно менее растворимы в воде. Их усвояемость может повышаться или, в случае образования новых дисульфидных связей, снижаться. С помощью процесса денатурации регулируют активность ферментов.
При температуре от 40–60 °С до 100 °С помимо денатурации протекает меланоидинообразование, а также образование изопептидных связей, например:
α α α α
L–NH–CH–CO–L L–NH–CH–CO–L L–NH–CH–CO–L L–NH–CH–CO–L
| | | |
β CH2 β CH2 β CH2 β CH2
 | + | | |
| + | | |
γ CH2 γ CH2 γ CH2 γ CH2
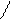
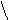 | | ε δ
| | ε δ
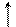 СОOH δ CH2 O = С — NH — CH2 — CH2
СОOH δ CH2 O = С — NH — CH2 — CH2
|
ε CH2 изопептидная связь
Остаток |
глутаминовой NH2 ε-(γ-Глутамиллизил)
кислоты Остаток лизина
Эта реакция протекает в белках молока и мяса.
При термической обработке белоксодержащей пищи при температуре 100–120 °С, например при стерилизации молочных, мясных, рыбных продуктов, происходит деструкция белков с отщеплением различных функциональных групп и разрывом пептидных связей. При этом образуются Н2S, NH3, CO2, диметилсульфид (Н3С–S–СН3), цистеиновая кислота (Н2N–CH–COОН) и другие соединения.
|
CH2
|
O = S = O
|
OH
Также могут протекать реакции дезамидирования аспарагина и глутамина, дегидратации глицина с образованием новых ковалентных связей, например:
Н2N – CH – COОН НN – CH – COОН
| | |
 CH2 O = C CH2
CH2 O = C CH2
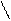
 | – NH3
| – NH3
CH2 CH2
| Пирролидонкарбоновая
О = С – NH2 (пироглутаминовая)
Глутамин кислота
 Н2N – CH2 – COОН НN – CH2 – C = O
Н2N – CH2 – COОН НN – CH2 – C = O
+ – 2H2О | |
НOОC – CH2 – NН2 О = C – CH2 – NН
Две молекулы глицина 2,5-Дикетопиперазин
Много 2,5-дикетопиперазина образуется при обжаривании какао-бобов.
При термической обработке белков выше 200 °С или при более низких температурах, но в щелочной среде, протекают реакции изомеризации аминокислотных остатков из L- в D-форму, что снижает усвояемость белков.
Среди продуктов термического распада белков встречаются соединения, обладающие мутагенными свойствами. Такие соединения образуются в белоксодержащей пище при её обжаривании в масле, выпечке, копчении в дыму, сушке. Мутагенными свойствами обладают продукты пиролиза аминокислот, образующиеся при температуре 500–600 °С.
В сильнощелочных средах, особенно при высоких температурах, в белках могут протекать реакции конденсации и образовываться различные поперечные связи, например:
L–NH–CH–CO–L L–NH–CH–CO–L L–NH–CH–CO–L L–NH–CH–CO–L
 | + | | |
| + | | |
CH2 CH3 CH2 CH2
| | |
CH2 Остаток CH2 — СН2 — CH2 — NH
| аланина
CH2 Лизилоаланил
|
CH2
|
NH2
Остаток лизина
Было установлено, что образование лизилоаланила стимулирует диарею и облысение. Образование подобных соединений снижает питательную ценность белков.
Белки могут окисляться продуктами окисления липидов. В свою очередь, окислительная порча липидов может начаться вследствие перемешивания, гомогенизации, замеса, ИК-обработки, ультразвуковой обработки сырья и полуфабрикатов. Предотвращение окислительной порчи липидов достигают добавлением антиоксидантов и другими способами.
При интенсивных воздействиях на белки также может происходить их тепловая агрегация и деструкция, сопровождающаяся разрывом не только дисульфидных, но даже пептидных связей.
Таким образом, использование новых и традиционных технологических процессов без глубокого изучения их влияния на структуру белков неэффективно с точки зрения обеспечения качества пищевых продуктов и опасно для здоровья людей.
Примером научно обоснованного подхода может служить применение аскорбиновой кислоты для улучшения качества хлеба:
СН2ОН
|


 НО–С–Н О
НО–С–Н О



 ½ О2 = О Г–S–S–Г
½ О2 = О Г–S–S–Г
 |



НО ОН
Аскорбиновая
кислота
СН2ОН
|


 НО–С–Н О
НО–С–Н О

 Н2О = О 2 Г–SН
Н2О = О 2 Г–SН




О О
Дегидроаскорбиновая
кислота
Аскорбиновая кислота окисляется кислородом воздуха до дегидроаскорбиновой кислоты и окисляет восстановленный глутатион до Г–S–S–Г, который не может взаимодействовать с дисульфидными связями теста и разрывать их. В результате SН-группы клейковинных белков могут образовывать дисульфидные связи между собой, что приводит к укреплению клейковины и улучшению качества хлеба.
Методы выделения и очистки белков
Белки, как известно, являются весьма лабильными соединениями и при неблагоприятных воздействиях могут денатурировать, а следовательно, и утратить свою биологическую функцию. Поэтому при их выделении и очистке необходимо придерживаться ряда общих правил, позволяющих избежать денатурации выделяемого белка. Во-первых, все процедуры по выделению белков следует вести при температуре как можно более низкой. Во-вторых, в растворы белка рекомендуется добавлять вещества, связывающие ионы тяжёлых металлов (например, ЭДТА — этилендиаминтетраацетат), а также вещества, поддерживающие на низком уровне окислительно-восстановительный потенциал (цистеин, восстановленный глутатион и др.). В-третьих, следует избегать сильного разбавления белковых растворов, так как это может привести к нарушению четвертичной структуры белка. И, в-четвёртых, реакция среды в растворах, содержащих белок, не должна быть сильнокислой или сильнощелочной.
В процессе выделения и очистки нужный белок отделяют от множества других содержащихся в клетках или ткани белков и небелковых соединений, исходя из таких его свойств, как размер его молекул, растворимость, изоэлектрическая точка, заряд и др. Выделение белка начинается с измельчения (гомогенизации) испытуемого материала (ткани, клеток). Затем проводится экстракция белков таким растворителем, который наиболее полно извлекает нужный белок. Для отделения белков от низкомолекулярных веществ можно использовать метод диализа. Путём осаждения органическими растворителями или солями (чаще всего сульфатом аммония) можно получить белковый осадок и затем его высушить лиофильным способом (в вакууме из замороженного состояния). Такой белковый препарат содержит смесь различных белков. Если необходимо получить белок в более чистом состоянии, применяют один или несколько методов разделения белков: электрофорез, изоэлектрическую фокусировку, гель-фильтрацию, ионообменную хроматографию и др.
Электрофорез. Этот метод разделения белков основан на том, что все они являются амфотерными электролитами и содержат положительно и отрицательно заряженные группировки, количество которых зависит от аминокислотного состава данного белка. В зависимости от величины и знака суммарного заряда, а также от размеров и формы молекулы разные белки передвигаются в электрическом поле с различной скоростью, на чём и основано их разделение.
Изоэлектрическая фокусировка белков. Этим методом белки разделяются на основе различий их изоэлектрических точек. Смесь различных белков наносится на колонку, заполненную амфолинами — смесью полиаминополикарбоновых кислот, способной в электрическом поле создавать непрерывный градиент pH. При пропускании электрического тока белки передвигаются по колонке до тех пор, пока не попадут в зону pH, соответствующую их изоэлектрической точке. Там они останавливаются. Затем получившиеся отдельные фракции белков собирают путём их вымывания из колонки.
Гель-фильтрация. Разделение белков при использовании этого метода проводится на основе различий в размерах их молекул. Пробу наносят на колонку, заполненную мелкими пористыми гранулами высокогидратированного нерастворимого углеводного полимера — сефадекса. Молекулы белков, имеющие сравнительно небольшие размеры, проникают через поры внутрь этих гранул, в результате чего их прохождение через колонку замедляется, тогда как молекулы более крупных белков не могут проникнуть внутрь гранул и проходят через колонку значительно быстрее.
Ионообменная хроматография. Разделение белков в данном случае происходит на основе различий в плотности и знаке их заряда. Если в нейтральной среде (при pH 7) белок имеет положительный заряд, то он связывается на колонке с ионообменником, содержащим карбоксильные группы (катионообменником), тогда как отрицательно заряженные белки с ионообменником не связываются, а если белок имеет отрицательный заряд, то он связывается на колонке с ионообменником, содержащим органические основания (анионообменником), и в этом случае с ионообменником не связываются положительно заряженные белки. Связавшиеся с сорбентом белки снимают с колонки путём их вымывания конкурирующим за место связывания с сорбентом раствором соли. Те белки, у которых плотность заряда ниже, вымываются с колонки первыми, за ними следуют белки с более высокой плотностью заряда.
Аффинная хроматография. Данный метод разделения белков основан на принципе их избирательного взаимодействия со специфическими веществами, закреплёнными на носителе. Через колонку, заполненную сорбентом, пропускают смесь белков. При этом все белки, не взаимодействующие с сорбентом, проходят через колонку свободно, и только белок, взаимодействующий с сорбентом, адсорбируется на колонке и задерживается в ней. Этот метод позволяет отказаться от многостадийных, трудоёмких схем выделения и очистки белков и получать высокоочищенные, однородные фракции белков непосредственно из белковых экстрактов.
Применяя методы разделения белков с целью выделения какого-то одного специфического белка из смеси многих белков, необходимо иметь удобный способ контроля, который позволял бы определять эффективность каждой стадии их разделения. Например, при очистке фермента измеряют его каталитическую активность и тем самым отличают от всех других белков. Все операции по выделению и очистке белков контролируют по выходу белка и по его специфической активности.
|
Дата добавления: 2014-01-20; Просмотров: 875; Нарушение авторских прав?; Мы поможем в написании вашей работы!