
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция №9. 2. Сероводород: строение, свойства
 |
Сера и её соединения.
1. Сера
2. Сероводород: строение, свойства.
3. Сравнительная характеристика оксидов серы (IV) и (VI): строение, свойства, применение.
4. Задачи на «избыток».
Сера
Сера представлена в природе четырьмя изотопами: 32S (95%), 33S, 34S и 36S. Значительное количество серы находится в виде простого вещества (самородная сера). Однако бóльшая часть серы входит в состав минералов, как сульфидных, так и сульфатных: ZnS - цинковая обманка, сфалерит; PbS - свинцовый блеск, галенит; Cu2S - медный блеск; HgS - киноварь; FeS2 - железный колчедан или пирит; CuFeS2 - халькопирит; Na2SO4×10H2O - глауберова соль или мирабилит; CaSO4×2H2O - гипс.
Элемент сера образует несколько аллотропных модификаций.
Физические свойства: твердое вещество желтого цвета, не имеет металлического блеска, нерастворима в воде.
Химические свойства:
1. Взаимодействует с металлами, кроме Au, Pt,Ru:
При комн.темп.: Hg + S= HgS
2Cu + S = Cu2S
2. Реагирует с неметаллами, кроме N2, I2:
S + O2 = SO2
H2 + S = H2S
2P + 5S = P2S5 (тиоангидрид фосфора)
3. Взаимодействует с сильными окислителями:
S + 6HNO3 (конц.)= H2SO4 + 6NO2 + 2H2O
3S + 4HNO3(разб.)= 3SO2 + 4NO + 2H2O
Применение: для получения сероуглерода, серной кислоты, пороха, спичек; для вулканизации каучука; как средство лечения кожных заболеваний; для защиты растений от болезней.
Сероводород: строение, свойства
Молекулярная формула – H2S, структурная
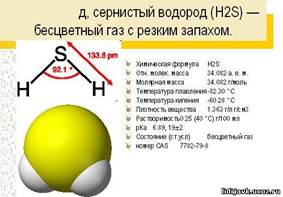
Физические свойства: бесцветный газ, с характерным запахом тухлых яиц, хорошо растворим в воде. Ядовит, поражает нервную систему.
Получение:
· H2 + S = H2S
· FeS + 2HCl = FeCl2 + H2S
Химические свойства:
4. Горит голубым пламенем:
2H2S + 3O2 = 2SO2 + 2H2O
2H2S + O2 = 2S + 2H2O
5. Взаимодействует с галогенами:
2H2S + I2 = S + 2HI
6. Сильные окислители окисляют H2S до соединений серы с различной С.О.:
|
|
|
H2S + 8HNO3(К.) = H2SO4 + 8NO2 +4H2O
H2S + 8HNO3(Р.) = SO2 + 2NO + 2H2O
3H2S + H2SO4(К.) = 4S + 4H2O
Водный раствор H2S – слабая двухосновная кислота. Соли сероводородной кислоты – сульфиды и гидросульфиды.
Применение: как реактив качественного и количественного анализа в аналитической химии.
Сравнительная характеристика оксидов серы (IV) и (VI): строение, свойства, применение
Оксид серы(IV) - бесцветный газ с резким неприятным запахом горящей серы. Молекула SO2 имеет угловое строение (угол OSO равен 119,5°):
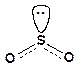
В промышленности SO2 получают обжигом пирита или сжиганием серы. Лабораторный метод получения диоксида серы - действие сильных минеральных кислот на сульфиты.
Na2SO3 + 2HCl = 2NaCl + SO2 + H2O
SO2 является энергичным восстановителем,
S+4O2 + Cl2 = S+6O2Cl2
но, взаимодействуя с сильными восстановителями, может выступать в роли окислителя:
2H2S + S+4O2 = 3S0 + 2H2O
Диоксид серы хорошо растворим в воде (40 объемов на 1 объем воды). В водном растворе гидратированные молекулы SO2 частично диссоциируют с образованием катиона водорода:
SO2×H2O  H+ + HSO3-
H+ + HSO3-  2H+ + SO32-
2H+ + SO32-
По этой причине водный раствор диоксида серы часто рассматривают как раствор сернистой кислоты - H2SO3, хотя реально это соединение, по-видимому, не существует. Тем не менее, соли сернистой кислоты устойчивы и могут быть выделены в индивидуальном виде:
SO2 + NaOH = NaHSO3; SO2 + 2NaOH = Na2SO3
гидросульфит натрия сульфит натрия
Сульфиты щелочных металлов хорошо растворимы в воде, в значительной мере гидролизованы:
SO32- + H2О  HSO3- + ОН-
HSO3- + ОН-
Сильные восстановители, при нагревании диспропорционируют:
4Na2S+4O3 = Na2S-2 + 3Na2S+6O4
Оксид серы(VI) - бесцветная жидкость (т.кип. 44,8 °С, т.пл. 16,8 °С). В газообразном состоянии SO3 имеет мономерное строение, в жидком - преимущественно существует в виде циклических тримерных молекул, в твердом состоянии - полимер.
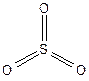
В промышленности триоксид серы получают каталитическим окислением ее диоксида.
t
|
|
|
2SO2 + O2 ¾® 2SO3
V2O5
В лаборатории SO3 можно получить перегонкой олеума - раствора триоксида серы в серной кислоте.
Химические свойства:
· Кислотный оксид:
SO3 + H2O = H2SO4
· Растворяется в H2SO4 (к.) с образованием олеума: H2SO4*xSO3
· Окислительные свойства:
SO3 +2HCl = SO2 + Cl2 + H2O
Применение: для производства серной кислоты.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 2150; Нарушение авторских прав?; Мы поможем в написании вашей работы!