
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопрос 2. Физические основы абсорбции
|
|
|
|
ВОПРОС №1. ОБЩИЕ СВЕДЕНИЯ
АБСОРБЦИЯ
План лекции:
- Общие сведения.
- Физические основы абсорбции.
- Материальный баланс и кинетика абсорбции.
- Принципиальные схемы.
- Конструкции абсорберов.
Абсорбцией называется процесс поглощения газов или паров (абсорбтивов) из газовых или паровых смесей жидкими поглотителями — абсорбентами. Этот процесс является избирательным и обратимым, что позволяет применять его для получения растворов газов в жидкостях, а также для разделения газовых или паровых смесей.
После абсорбции одного или нескольких компонентов из газовой или паровой смеси, как правило, проводят десорбцию, т. е. выделение этих компонентов из жидкости. Таким образом осуществляют разделение газовой смеси.
Существуют физическая абсорбция и хемосорбция. При физической абсорбции в процессе растворения газа не происходит химической реакции. При хемосорбции абсорбируемый газ вступает в химическую реакцию в жидкой фазе.
Процессы абсорбции в технике применяют для разделения углеводородных газов и получения соляной и сернистой кислот, аммиачной воды, очистки отходящих газов с целью улавливания ценных продуктов или обезвреживания газосбросов.
Аппаратурно-технологическое оформление абсорбции несложно, поэтому процессы абсорбции широко используют в технике.
Аппараты для проведения процессов абсорбции называются абсорберами.
При взаимодействии газа с жидкостью возникает система, состоящая из двух фаз (Ф = 2) и трех компонентов — распределяемого вещества и двух веществ-носителей (К = 3). Согласно правилу фаз такая система имеет три степени свободы:
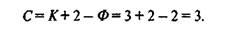
Тремя основными параметрами, определяющими фазовое равновесие в системе, являются давление, температура и концентрация.
|
|
|
В этом случае можно произвольно изменять общее давление р, температуру t и концентрацию х распределяемого вещества в одной из фаз. При постоянных температуре и давлении, как в процессах абсорбции, каждой концентрации распределяемого вещества в одной фазе соответствует строго определенная концентрация в другой.
В условиях равновесия при t = const зависимость между равновесными концентрациями выражается законом Генри, который гласит: при данной температуре мольная доля газа в растворе прямо пропорциональна парциальному давлению газа над раствором:
 (1)
(1)
или

Константа Генри зависит от природы растворяющегося вещества (абсорбтива), абсорбента и температуры
 (2)
(2)

Из равенства (2) видно, что с ростом температуры растворимость газов в жидкостях уменьшается. Парциальное давление растворяемого газа в газовой фазе, соответствующее равновесию, может быть заменено равновесной концентрацией. Согласно закону Дальтона парциальное давление компонента в газовой смеси равно общему давлению, умноженному на мольную долю этого компонента в смеси, т. е.
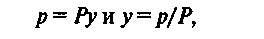 (3)
(3)
Где Р - общее давление газовой смеси; у – концентрация распределяемого вещества в смеси; доли моля
Сопоставляя уравнения (3) и (1), найдем
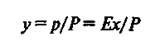
или, обозначая константу фазового равновесия Е/Р через т, получим
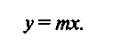 (4)
(4)
Уравнение (4) показывает, что зависимость между равновесными концентрациями распределяемого компонента в газовой смеси и в жидкости выражается прямой линией, проходящей через начало координат, тангенс угла наклона которой равен т. Тангенс угла наклона зависит от температуры и давления. С увеличением давления и уменьшением температуры растворимость газа в жидкости увеличивается (т снижается) (рис. 1). Когда в равновесии с жидкостью находится смесь газов, то закону Генри может следовать каждый из газовых компонентов смеси.
|
|
|
Процессы абсорбции можно рассчитывать в относительных мольных концентрациях. В этом случае при малой концентрации газа х в жидкости закон Генри записывается так:
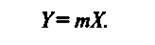

Рис. 1. Зависимость между растворимостью газов в
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 523; Нарушение авторских прав?; Мы поможем в написании вашей работы!