
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Адсорбция
|
|
|
|
Лекция №20
Адсорбцией называют поглощение газов, паров и жидкостей твердыми пористыми телами, носящими название адсорбентов; адсорбируемое вещество, находящееся в газе или жидкости, называют адсорбтивом, а после его перехода в фазу адсорбента – адсорбатом. Используемые на практике адсорбенты обладают сильно развитой внутренней поверхностью (до 1000 м2/г), образующейся путем специальной обработки или синтеза твердых материалов.
Механизм процесса адсорбции отличается от механизма абсорбции, так как извлечение вещества осуществляется твердым, а не жидким поглотителем.
Адсорбцию подразделяют на два вида: физическую и химическую. Физическая адсорбция в основном обусловлена поверхностными вандерваальсовыми силами, которые проявляются на расстояниях, значительно превышающих размеры адсорбируемых молекул, поэтому на поверхности адсорбента обычно удерживаются несколько слоев молекул адсорбата. При химической адсорбции поглощаемое вещество вступает в химическое взаимодействие с адсорбентом с образованием на его поверхности обычных химических соединений.
Силы притяжения возникают на поверхности адсорбента благодаря тому, что силовое поле поверхностных атомов и молекул не уравновешенно силами взаимодействия соседних частиц. По физической природе силы взаимодействия молекул поглощаемого вещества и адсорбента относятся в основном к дисперсионным, возникающим благодаря перемещению электронов в сближающихся молекулах. В ряде случаев адсорбции большое значение имеют электростатические и индукционные силы, а также водородные связи.
Заполнение адсорбатом поверхности адсорбента частично уравновешивает поверхностные силы и вследствие этого снижает поверхностное натяжение (свободную удельную поверхностную энергию). Поэтому адсорбция является самопроизвольным процессом, течение которого сопровождается уменьшением свободной энергии и энтропии системы.
|
|
|
Процессы адсорбции избирательны и обратимы. Процесс, обратный адсорбции, называют десорбцией, которую используют для выделения поглощенных веществ и регенерации адсорбента.
Наиболее рационально адсорбцию применять для обработки смесей с низкой концентрацией извлекаемых веществ. В этом случае увеличивается продолжительность работы адсорбционного аппарата – адсорбера – на стадии собственно адсорбции до его переключения на десорбцию.
Типичными примерами адсорбции являются осушка газов и жидкостей, разделение смесей углеводородов, рекуперация растворителей, очистка вентиляционных выбросов и сточных вод и т.п. За последнее время значение адсорбции существенно возросло, особенно в связи с решением экологических проблем и проблем получения особо чистых веществ [26–28].
8.1. Основные промышленные адсорбенты и их свойства [1]
Основными промышленными адсорбентами являются пористые тела, обладающие большим объемом микропор. Свойства адсорбентов определяются природой материала, из которого они изготовлены, и пористой внутренней структурой.
В промышленных адсорбентах основное количество поглощенного вещества сорбируется на стенках микропор (r < 10–9 м). Роль переходных пор (10–9 < r < 10–7 м) и макропор (r > 10–7 м) в основном сводится к транспортированию адсорбируемого вещества к микропорам.
Адсорбенты характеризуются своей поглотительной, или адсорбционной, способностью, определяемой максимально возможной концентрацией адсорбтива в единице массы или объема адсорбента. Величина поглотительной способности зависит от типа адсорбента, его пористой структуры, природы поглощаемого вещества, его концентрации, температуры, а для газов и паров – от их парциального давления. Максимально возможную при данных условиях поглотительную способность адсорбента условно называют равновесной активностью.
|
|
|
По химическому составу все адсорбенты можно разделить на углеродные и неуглеродные. К углеродным адсорбентам относятся активные (активированные) угли, углеродные волокнистые материалы, а также некоторые виды твердого топлива. Неуглеродные адсорбенты включают в себя силикагели, активный оксид алюминия, алюмогели, цеолиты и глинистые породы.
Активные угли, состоящие из множества беспорядочно расположенных микрокристаллов графита, обычно используют для поглощения органических веществ в процессах очистки и разделения жидкостей и газов (паров). Эти адсорбенты получают сухой перегонкой ряда углеродсодержащих веществ (древесины, каменного угля, костей животных, косточек плодов и др.) с целью удаления летучих. После этого уголь активируют, например прокаливают его при температуре 850–900 °С, что приводит к освобождению пор от смолистых веществ и образованию новых микропор. Активацию проводят также экстрагированием смол из пор органическими растворителями, окислением кислородом воздуха и др. Более однородная структура углей получается при их активации химическими методами: путем их обработки горячими растворами солей (например, сульфатами, нитратами и др.) или минеральными кислотами (серной, азотной и др.).
Удельная поверхность активных углей очень высока и составляет 6×105–17×105 м2/кг, а их насыпная плотность 200–900 кг/м3. Активные угли применяют в виде частиц неправильной формы размером 1–7 мм, цилиндров диаметром 2–3 мм и высотой 4–6 мм и порошка с размером частиц менее 0,15 мм. Последний вид активных углей применяют для разделения растворов.
К основным недостаткам активных углей относится их горючесть и невысокая механическая прочность.
Силикагель – обезвоженный гель кремниевой кислоты (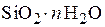 ) – используют для адсорбции полярных соединений. Его применяют в процессах осушки газов и жидкостей, при разделении органических веществ в газовой фазе и в хроматографии. Силикагель получают обработкой раствора силиката натрия (растворимое стекло) серной кислоты (иногда хлороводородной) или растворами солей, имеющих кислую реакцию. Образовавшийся гель промывают водой и сушат до конечной влажности 5–7 %, так как при такой влажности силикагель обладает наибольшей адсорбционной способностью. Удельная поверхность силикагеля составляет 4×105–7,7×105 м2/кг, насыпная плотность – 400–800 кг/м3. Размер частиц неправильной формы изменяется в довольно широком интервале – от 0,2 до 7 мм.
) – используют для адсорбции полярных соединений. Его применяют в процессах осушки газов и жидкостей, при разделении органических веществ в газовой фазе и в хроматографии. Силикагель получают обработкой раствора силиката натрия (растворимое стекло) серной кислоты (иногда хлороводородной) или растворами солей, имеющих кислую реакцию. Образовавшийся гель промывают водой и сушат до конечной влажности 5–7 %, так как при такой влажности силикагель обладает наибольшей адсорбционной способностью. Удельная поверхность силикагеля составляет 4×105–7,7×105 м2/кг, насыпная плотность – 400–800 кг/м3. Размер частиц неправильной формы изменяется в довольно широком интервале – от 0,2 до 7 мм.
|
|
|
К достоинствам силикагелей относится их негорючесть и большая механическая прочность, чем у активных углей. Недостатком силикагелей по сравнению с активными углями является, помимо их более низкой удельной поверхности, резкое снижение поглотительной способности по отношению к парам органических веществ в присутствии влаги.
По сорбционным свойствам к силикагелю близко примыкают алюмогели, получаемые термической обработкой гидроксида алюминия [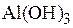 ] при температурах 600–1000 °С. Поры полученного сорбента (92 %
] при температурах 600–1000 °С. Поры полученного сорбента (92 % 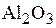 ) имеют диаметр 1–3 нм, удельную поверхность 2×105–4×105 м2/кг; насыпная плотность такого сорбента 1600
) имеют диаметр 1–3 нм, удельную поверхность 2×105–4×105 м2/кг; насыпная плотность такого сорбента 1600 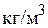 . Алюмогели используют для осушки газов, очистки водных растворов и минеральных масел, применяют в качестве катализаторов и их носителей.
. Алюмогели используют для осушки газов, очистки водных растворов и минеральных масел, применяют в качестве катализаторов и их носителей.
Цеолиты представляют собой природные или синтетические минералы, которые являются водными алюмосиликатами, содержащими оксиды щелочных и щелочноземельных металлов. Эти адсорбенты отличаются регулярной структурой пор, размеры которых соизмеримы с размерами поглощаемых молекул. Особенность цеолитов состоит в том, что адсорбционные поверхности соединены между собой окнами определенного диаметра, через которые могут проникать только молекулы меньшего размера. На этом основано разделение смесей с разными по размеру молекулами, что послужило причиной называть цеолиты молекулярными ситами.
Для разделения газовых смесей применяют цеолиты в виде шариков или гранул размером от 1 до 5 мм, а для разделения жидких смесей – в виде мелкозернистого порошка.
|
|
|
Особенно широко цеолиты используют для глубокой осушки газов и жидкостей, в процессах очистки и разделения смесей веществ с близкой молекулярной массой, а также в качестве катализаторов и их носителей.
Для очистки жидкостей от различных примесей в качестве адсорбентов применяют природные глинистые породы. Эти глины для их активации обрабатывают серной или хлороводородной кислотами и получают адсорбент с удельной поверхностью пор порядка (1,0÷1,5)·105 м2/кг. Также для очистки жидкостей могут применяться некоторые виды торфов.
Отметим, что адсорбенты характеризуются еще статической и динамической активностью. Под статической активностью понимают количество вещества, поглощенного единицей массы или объема адсорбента от начала адсорбции до установления равновесия. Этот вид активности определяют в статических условиях, т.е. без движения смеси газов или раствора. При движении смеси сквозь слой адсорбента через определенный промежуток времени адсорбент перестает полностью поглощать извлекаемый компонент, и происходит «проскок» этого компонента с последующим увеличением концентрации компонента в уходящей из слоя смеси вплоть до наступления равновесия. Количество вещества, поглощенного единицей массы или объема адсорбента до начала проскока, называют динамической активностью адсорбента. Динамическая активность всегда меньше статической, поэтому количество адсорбента определяют по его динамической активности.
Равновесие при адсорбции [1]
Равновесная концентрация 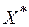 (кг/кг чистого адсорбента) поглощаемого вещества в адсорбенте может быть представлена в виде функции концентрации с и температуры Т:
(кг/кг чистого адсорбента) поглощаемого вещества в адсорбенте может быть представлена в виде функции концентрации с и температуры Т:
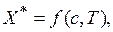
или в виде функции парциального давления р и температуры Т в случае адсорбции газов:
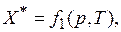
где с – концентрация адсорбтива в объемной фазе, кг/м3; р – парциальное давление адсорбтива в объемной фазе, Па.
Между концентрацией  адсорбируемого вещества в газовой смеси и его парциальным давлением р, согласно уравнению Клапейрона, существует прямая пропорциональность:
адсорбируемого вещества в газовой смеси и его парциальным давлением р, согласно уравнению Клапейрона, существует прямая пропорциональность:
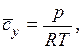 (8.1)
(8.1)
где R – газовая постоянная, Дж/(кг·К).
Зависимость 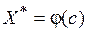 или
или  при постоянной температуре называется изотермой адсорбции.
при постоянной температуре называется изотермой адсорбции.
Изотермы адсорбции изображаются кривыми, форма которых определяется в основном природой адсорбата и адсорбента и его пористой структурой. Из всего многообразия форм изотерм для анализа процессов адсорбции следует выделить выпуклую и вогнутую (рис. 8.1). Важно отметить, что начальные участки изотерм линейны.
Равновесные зависимости описываются рядом эмпирических и теоретических уравнений. Наиболее плодотворной для описания равновесия адсорбционных процессов оказалась теория объемного заполнения пор, явившаяся развитием потенциальной теории адсорбции.
Под адсорбционным потенциалом А понимают работу, совершаемую адсорбционными силами при переносе одного моля адсорбтива из равновесной газовой фазы давлением р на поверхность адсорбционной пленки, давление над которой принимается равным давлению насыщенного пара адсорбтива pS при рассматриваемой Т.

Рис. 8.1. Выпуклая и вогнутая изотермы адсорбции
Адсорбционный потенциал выражается соотношением
 (8.2)
(8.2)
В процессе адсорбции объем микропор V п заполняется адсорбатом, объем которого может быть вычислен через величину равновесной адсорбции:
 (8.3)
(8.3)
где М – молекулярная масса адсорбата; V – молярный объем адсорбата.
Установлено, что для разных веществ, адсорбирующихся на одном адсорбенте, отношение адсорбционных потенциалов при одинаковых значениях V п постоянно и равно коэффициенту аффинности b, представляющему собой отношение молярных объемов в жидком состоянии, или парахоров, данного и стандартного вещества, значение которого находят в справочнике.
Для ряда микропористых адсорбентов распределение различных заполненных участков адсорбционных объемов имеет вид распределения Гаусса:
 (8.4)
(8.4)
где W 0 – общий объем микропор; Е – параметр функции распределения.
При совместном решении уравнений (8.2) и (8.3) с учетом коэффициента аффинности получено уравнение, описывающее изотермы адсорбции для микропористых адсорбентов с однородной пористой структурой (синтетические цеолиты):
 (8.5)
(8.5)
Для адсорбентов со сложными микропористыми структурами (микропористые силикагели, активные угли)
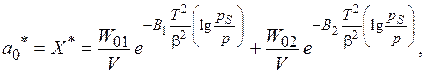 (8.6)
(8.6)
где  – константы характеризующие адсорбент; Т – температура.
– константы характеризующие адсорбент; Т – температура.
Наряду с соотношениями, основанными на теории объемного заполнения пор, для описания адсорбционного равновесия используют ряд других уравнений, среди которых наиболее известно уравнение Ленгмюра:
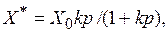 (8.7)
(8.7)
где X 0 – предельная величина адсорбции (количество компонента, адсорбированного при полном мономолекулярном покрытии поверхности адсорбента); k – константа, зависящая от температуры.
Для описания равновесных соотношений (особенно при адсорбции газов или паров) используется также уравнение Фрейндлиха:
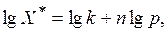 (8.8)
(8.8)
где k и n – величины, приводимые в справочной литературе.
Расчет равновесия адсорбции многокомпонентных смесей особенно важен в процессах разделения смесей (жидких и газовых). Селективность (избирательность) адсорбента оценивается коэффициентом 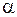 разделения:
разделения:
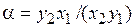 ,
,
где  – молярные концентрации в твердой и объемной фазе лучше и хуже адсорбирующегося вещества соответственно.
– молярные концентрации в твердой и объемной фазе лучше и хуже адсорбирующегося вещества соответственно.
В случае, когда в смеси присутствуют два адсорбтива, равновесие аналогично бинарным смесям в системе жидкость-пар, представляется графически в координатах y – x.
Согласно теории Эйкена и Поляни, располагая изотермой адсорбции пара стандартного вещества для температуры 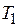 , можно вычислить изотерму адсорбции другого пара при температуре
, можно вычислить изотерму адсорбции другого пара при температуре  .
.
Для вычисления величин адсорбции служит формула
 (8.9)
(8.9)
где  – ордината изотермы стандартного вещества (обычно бензола), кг/кг или ммоль/г;
– ордината изотермы стандартного вещества (обычно бензола), кг/кг или ммоль/г;  – ордината определяемой изотермы, кг/кг или ммоль/г;
– ордината определяемой изотермы, кг/кг или ммоль/г;  – мольные объемы стандартного и исследуемого веществ (в жидком состоянии), м3/кмоль.
– мольные объемы стандартного и исследуемого веществ (в жидком состоянии), м3/кмоль.
Мольные объемы определяются по формуле
 . (8.10)
. (8.10)
Здесь М – мольная масса, кг/кмоль; r – плотность жидкости, кг/м3.
Давления вычисляются по формуле
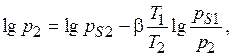 (8.11)
(8.11)
где 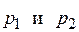 – парциальные давления стандартного и исследуемого веществ, мм рт. ст.;
– парциальные давления стандартного и исследуемого веществ, мм рт. ст.; 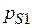 – давление насыщенного пара стандартного вещества при температуре
– давление насыщенного пара стандартного вещества при температуре 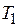 (выраженной в К), мм.рт.ст.;
(выраженной в К), мм.рт.ст.;  – давление насыщенного пара исследуемого вещества при температуре
– давление насыщенного пара исследуемого вещества при температуре  (выраженной в К), мм рт. ст.;
(выраженной в К), мм рт. ст.;  – коэффициент аффинности, равный отношению мольных объемов,
– коэффициент аффинности, равный отношению мольных объемов,
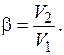 (8.12)
(8.12)
При расчете точек изотермы исследуемого пара координаты 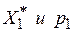 берутся по кривой стандартного вещества, значения
берутся по кривой стандартного вещества, значения 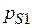 и
и  – из таблиц давления насыщенного пара,
– из таблиц давления насыщенного пара,  – вычисляется по формуле (8.11).
– вычисляется по формуле (8.11).
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 3937; Нарушение авторских прав?; Мы поможем в написании вашей работы!