
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Эквивалентная электропроводность и подвижность ионов
|
|
|
|
Эквивалентная электропроводность ( λ ) – это электропроводность раствора, содержащего 1 моль экв электролита, измеренная при расстоянии между электродами l = 1 см.
Единица измерения λ– См×см2/моль экв.
λ нельзя измерить, её рассчитывают:
 ,
,
где С – молярная концентрация эквивалента.
Факторы, влияющие на λ:
1. Природа электролита:
λ = α (λ+ + λ–),
где α – степень диссоциации;
λ+ и λ– – подвижности ионов:
λ+ = F × U ±,
где F – число Фарадея;
U ± – скорости движения ионов.
В разбавленных растворах при С ® 0 степень диссоциации α ® 1, следовательно:
λ0 = λ+0 + λ–0 (закон независимого движения ионов, уравнение Кольрауша),
где λ0 – предельная электропроводность (при бесконечном разбавлении);
λ+0 и λ–0 – предельные подвижности ионов (индивидуальные характеристики ионов, приведены в таблицах).
2. Температура (t о): чем больше t о, тем больше λ.
3. Концентрация электролита (С): чем больше С, тем меньше λ.
Для разбавленного раствора сильного электролита при z± = 1:
λ = λ0 – В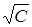 (уравнение Онзагера),
(уравнение Онзагера),
где В – константа.
Как видно из уравнения Онзагера, для получения линейной зависимости лучше всего строить график в координатах λ = f (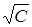 ) (рис. 13).
) (рис. 13).

Рис. 13. Зависимость эквивалентной электропроводности от концентрации
При этом:
· в разбавленных растворах зависимость λ = f (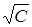 ) – линейная;
) – линейная;
· в концентрированных – наблюдаются отклонения от линейности по тем же причинам, что и для χ.
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 848; Нарушение авторских прав?; Мы поможем в написании вашей работы!