
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексонометрия
Совокупность методов объемного анализа, основанных на применении комплексонов, называется комплексонометрией.
Комплексоны представляют собой полиаминополикарбоновые кислоты и их производные. Известно более 200 комплексонов, из них наиболее важное значение в определении металлов имеет этилендиаминтетрауксусная кислота (иначе ЭДТУ), сокращенно H4Y, где Y4-—анион ЭДТУ, и особенно ее двунатриевая соль, известная под названием комплексона III (трилона Б или ЭДТА), сокращенно Na2Н2Y*2H2O.
Этилендиаминтетрауксусная кислота четырехосновна:
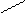
 HOOCH2C CH2COOH
HOOCH2C CH2COOH

 N – CH2 – CH2 – N HOOCH2C CH2COOH
N – CH2 – CH2 – N HOOCH2C CH2COOH
Трилон Б
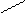
 HOOCH2C CH2COOH
HOOCH2C CH2COOH

 N – CH2 – CH2 – N NaOOCH2C CH2COONa
N – CH2 – CH2 – N NaOOCH2C CH2COONa
Четыре ступени диссоциации ее характеризуются следующими величинами констант: К1=10-2, K2 = 1,8*10-3, К3=6,9*10-7, К4=5,5*10-11. Характер диссоциации определяется средой раствора: при рН>12 кислота ионизирована полностью.
В сокращенном виде взаимодействие комплексона III с металлами различной степени окисления можно представить уравнениями:
Ме2+ + Na2H2Y = Na2MeY + 2Н+
Ме3+ + Na2H2Y = NaMeY + 2Н+ + Na+
Me4+ + Na2H2Y = MeY + 2Н+ + 2Na+
Все реакции между комплексоном III и катионами отвечают стехиометрическому соотношению 1: 1, т. е. на 1 г-экв металла* всегда приходится 1 г-экв комплексона.
В комплексонометрии эквивалент любого металла равен половине атомной массы (т.к. замещает 2 атома водорода)
Комплексонометрическое титрование сопровождается выделением ионов Н+. рН раствора влияет, следовательно, на равновесие реакций комплексообразования, а также на устойчивость образующихся комплексов. Все комплексонометрические титрования проводят при определенном значении рН, поддерживая его с помощью различных буферных смесей.
Разработаны комплексонометрические методы определения почти для всех металлов, а также для многих анионов. При этом широко пользуются приемами прямого и обратного титрования, титрования заместителей, приемами косвенных определений, маскировки мешающих ионов и т. п.
Для установления точки эквивалентности используют:
а) специфические индикаторы — вещества, реагирующие только с определяемым ионом; например, Fe3+ титруют комплексоном III при рН 2 в присутствии роданидов, салицилатов и других соединений, образующих с Fe3+ окрашенные продукты;
б) металл-индикаторы (иначе металлохромные индикаторы) — органические красители, как правило, многоосновные кислоты, образующие с ионами металлов окрашенные в яркий цвет комплексные соединения Melnd. Важнейшими металл-индикаторами являются эриохром черный Т и мурексид.
Титрование проводят обычно в буферных смесях.
Для поддержания рН на требуемом уровне в титруемую смесь добавляют обычно аммиачный буфер.
Условия титрования цинка Трилоном Б с различными индикаторами
| Определяемый ион | Тип титрования | Индикатор | Условия титрования |
| Zn2+ | прямое | хромогеновый черный | рН=10 t=60оС |
| Zn2+ | прямое | ПАН | рН = 6,0 – 6,4 |
| Zn2+ | прямое | ксиленоловый оранжевый | рН = 5 – 6 ацетатный буфер |
| Zn2+ | прямое | мурексид | рН = 8 – 9 к аммиач. р-ру добавл. аскорбиновую к-ту до обесцвечивания р-ра и титр. |
В комплексонометрии применяются также в) редокс-индикаторы; г)обычные кислотно-основные индикаторы.
Комплексон III используется в объемном анализе главным образом как титрант, в отдельных случаях—для смещения окислительно-восстановительного потенциала, в качестве маскирующего средства.
|
|
Дата добавления: 2014-01-20; Просмотров: 1805; Нарушение авторских прав?; Мы поможем в написании вашей работы!