
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Факторы, влияющие на скорость ферментативных реакций
|
|
|
|
Классификация ферментов
Схема номенклатуры ферментов была впервые разработана в 1955 году, когда Международный конгресс биохимии в Брюсселе учредил Комиссию по ферментам (Enzyme Commission). Первая версия номенклатуры появилась в 1961 году и включала около 900 ферментов, в версии 1978 года было более 2000 ферментов. Версия 1995 года содержит более 3500 ферментов.
Ферменты были подразделены на шесть классов в соответствии с общим типом реакции, которую они катализируют. Каждый фермент получил систематическое наименование, точно описывающее катализируемую им реакцию. Поскольку многие из этих систематических названий оказались очень длинными и сложным, каждому ферменту было присвоено «тривиальное» - рабочее название. Рабочее название состоит из названия субстрата, на который действует данный фермент, указания на тип катализируемой реакции и окончания «аза».
Таблица 2.
Классификация ферментов
| Группа | Катализируемые реакции | Типичная реакция | Примеры ферментов |
| Оксидазы | Перенос антомов Н, О или электронов от одного вещества к другому | АН+В↔А+ВН А+О↔АО | Дегидрогеназа, оксидаза |
| Трасферазы | Перенос определенной группы атомов (метильной, ацильной, фосфатной, аминогруппы) от одного вещества к другому | АВ+С↔А+ВС | Киназа, трансаминаза |
| Гидролазы | Реакции гидролиза, при которых из субстрата образуется два продукта | АВ+Н2О↔АОН+ВН | Липаза, амилаза, пептидаза |
| Лиазы | Негидролитическое присоединение к субстрату или отщепление от него группы атомов. При этом могут разрываться связи: С-С, С-N, С-О, С-S | R-СО-СООН↔ R-СОН+ СО2 | Декарбоксилаза, фумараза, альдолаза |
| Изомеразы | Внутримолекулярная перестройка | АВ↔ВА | Изомераза, мутаза |
| Лигазы | Соединение двух молекул в результате образования новых связей С-О, С-N, С-S, сопряженное с распадом АТР | X+Y+АТР↔XY+АДР+Р | Синтетаза |
|
|
|
При изучении влияния какого-либо фактора на скорость ферментативной реакции все прочие факторы должны оставаться неизменными и по возможности иметь оптимальные значения.
1. Концентрация фермента. При высокой концентрации субстрата и при постоянстве других факторов, скорость ферментативной реакции пропорциональна концентрации фермента.
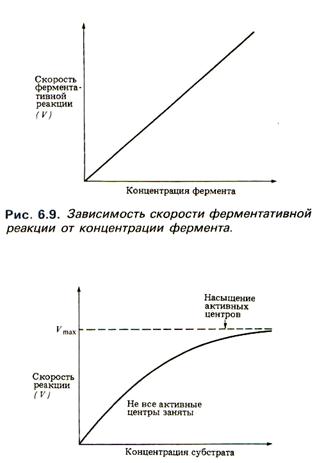
2. Концентрация субстрата. При данной концентрации фермента скорость ферментативной реакции возрастает с увеличением концентрации субстрата, но до определенного значения. После насыщения активных центров фермента дальнейшее увеличение концентрации субстрата не приводит увеличению скорости реакции. Поэтому при высоких концентрациях субстрата скорость ферментативной реакции лимитируется и концентрацией субстрата, и временем, которое требуется для диссоциации фермент-субстратного комплекса.
3. Температура. Влияние температуры на скорость ферментативной реакции может быть выражено через температурный коэффициент Q10
Q10 = Скорость реакции при (х +10)°С
Скорость реакции при х°С
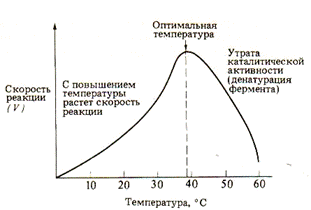
Рис. Влияние температуры на скорость ферментативной реакции
В пределах 0-40°С Q10 ферментативной реакции равен 2, т.е. при каждом повышении температуры на 10°С скорость ферментативной реакции удваивается. Температура, обеспечивающая наибольшую активность. Называется оптимальной температурой. За пределами этого уровня скорость ферментативной реакции снижается. Это происходит вследствие разрушения вторичной и третичной структур фермента – денатурации. Когда температура приближается к точке замерзания или оказывается ниже ее, ферменты инактивируются, но денатурации при этом не происходит. С повышением температуры их каталитическая активность восстанавливается.
|
|
|
4. рН. При постоянной температуре любой фермент работает наиболее эффективно в узких пределах рН. Оптимальным считается то значение рН, при котором реакция протекает с максимальной скоростью. При более высоких и при более низких рН активность фермента снижается. При слишком резких сдвигах рН фермент денатурирует.

Рис Влияние рН на активность фермента
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 3974; Нарушение авторских прав?; Мы поможем в написании вашей работы!