
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения хлора – хлориды
Хлориды образуют большинство элементов периодической системы Д.И. Менделеева. Степень окисления хлора равна –1. Хлориды активных металлов – ионные хлориды – это вещества с ионным типом химической связи. Ионные хлориды – твердые вещества, образуют ионные кристаллические решетки и обладают высокими температурами плавления и кипения. Например, NaCl, MgCl2.
Хлориды менее активных металлов и неметаллов – ковалентные хлориды – это вещества с ковалентной полярной связью. Ковалентные хлориды – газы, жидкости или легкоплавкие твердые вещества, которые имеют кристаллические решетки молекулярного типа и обладают низкими температурами кипения и плавления. Например, PCl5.
Промежуточное положение между ионными и ковалентными хлоридами занимают ионно-ковалентные хлориды. Это вещества c ковалентной полярной связью близкой к ионной.
Большинство хлоридов металлов хорошо растворимы в воде (за исключением AgCl, CuCl, AuCl, TlCl, PbCl2).
Хлориды подразделяют на основные, кислотные и амфотерные. Ионные хлориды являются основными соединениями, а ковалентные хлориды – кислотными.
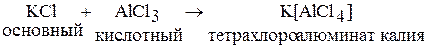
Основные хлориды являются донорами электронных пар (за счет Cl–), а кислотные акцепторами.
Амфотерные хлориды взаимодействуют как с основными, так и с кислотными хлоридами с образованием комплексных хлоридов:
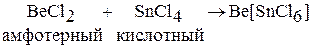

Основные хлориды (ионные хлориды) гидролизу не подвергаются. Хлориды неактивных металлов гидролизуются по катиону (гидролиз по типу гидролиза солей, по ионному механизму).
Хлориды неметаллов (кислотные хлориды) гидролизуются по молекулярному механизму.
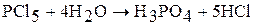
Отличие от гидролиза солей: а) протекает по молекулярному механизму; б) протекает практически полностью и необратимо; г) в результате гидролиза образуются две кислоты.
|
|
Дата добавления: 2014-01-20; Просмотров: 1327; Нарушение авторских прав?; Мы поможем в написании вашей работы!