
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость химических реакций. Под скоростью химической реакции понимается изменение количества вещества за какой-то промежуток времени:
|
|
|
|
Под скоростью химической реакции понимается изменение количества вещества за какой-то промежуток времени:
 .
.
Различают скорость реакции в гомогенных (однородных) и гетерогенных (неоднородных) системах. В гомогенных системах реакции протекают по всему объему:
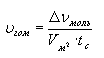 .
.
В гетерогенных системах реакции протекают на границе фаз, поэтому изменение количества вещества относят к площади раздела фаз:
 .
.
Скорость реакции зависит от следующих факторов:
· природа реагирующих веществ;
· концентрация реагирующих веществ;
· газовое давление;
· температура.
Зависимость скорости реакции от концентрации реагирующих веществ подчиняется закону действия масс.
Запишем химическую реакцию в общем виде:
 .
.
Если считать, что реакция протекает в гомогенной среде, то закон действия масс для неё выглядит следующим образом:
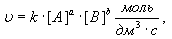 ,
,
где
[А] и [В] - молярные концентрации веществ А и В;
а и в - показатели степеней, соответствующие количеству моль веществ А и В;
к - константа скорости реакции, зависящая от температуры, но не зависящая от концентрации реагирующих веществ.
Рассмотрим закон действия масс для конкретных реакций:
 .
.
Цинк - твердое вещество, его участие в реакции учитывается константой скорости химической реакции.
Влияние температуры на скорость химической реакции подчиняется уравнению Вант-Гоффа:

где
ν - начальная скорость реакции;
ν'- измененная скорость;
γ- температурный коэффициент;
Δt0- изменение температуры реакции.
При изменении температуры на 10oС, скорость реакции  изменяется в 2÷4 раза, т. е. температурный коэффициент находится в пределах от 2 до 4.
изменяется в 2÷4 раза, т. е. температурный коэффициент находится в пределах от 2 до 4.
Зависимость константы скорости реакции от температуры также подчиняется уравнению Вант-Гоффа:
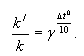
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 442; Нарушение авторских прав?; Мы поможем в написании вашей работы!