
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диссоциация слабых электролитов
|
|
|
|
Суть диссоциации слабых электролитов в том, что они диссоциируют на ионы не полностью, обратимо.
Диссоциация слабых электролитов:
 .
.
Диссоциация слабых электролитов имеет две количественные характеристики:
1) λ - степень диссоциации. Степень диссоциации не является константой, она зависит от двух факторов:
· от температуры (прямая зависимость);
· от концентрации раствора (обратная зависимость).
2) Константа диссоциации - это, по сути, константа равновесия обратимой реакции.
Кр=КД=[A+]р*[B+]р/[AB]р.
Константа диссоциации изменяется с температурой, причём зависимость прямая. От концентрации растворов константа диссоциации не зависит.
Взаимосвязь между степенью и константой диссоциации установил немецкий химик Оствальд.
 .
.
Для слабых электролитов степень диссоциации много меньше единицы и поэтому в знаменателе формулы закона Оствальда ею пренебрегают.
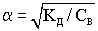 - закон разбавления Оствальда.
- закон разбавления Оствальда.
Многие слабые электролиты диссоциируют ступенчато. Каждая ступень имеет свою константу диссоциации
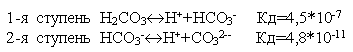 .
.
По первой ступени диссоциация заметна при нормальных условиях (при комнатной температуре).
Диссоциация по второй ступени заметна при повышенной температуре, особенно при температуре кипения.
Всегда
Кд1>Кд2>Кд3
Сr(OH)3
 .
.
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 465; Нарушение авторских прав?; Мы поможем в написании вашей работы!