
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Металлы
Железо общее.
Главными источниками соединений железа в поверхностных водах являются процессы химического выветривания горных пород, сопровождающиеся их механическим разрушением и растворением. В процессе взаимодействия с содержащимися в природных водах минеральными и органическими веществами образуется сложный комплекс соединений железа, находящихся в воде в растворенном, коллоидном и взвешенном состояниях. Значительные количества железа поступают с подземным стоком и со сточными водами предприятий металлургической, металлообрабатывающей, текстильной, лакокрасочной промышленности и с сельскохозяйственными стоками.
Фазовые равновесия зависят от химического состава вод, рН и в некоторой степени от температуры. В рутинном анализе во взвешенную форму выделяют частицы с размером более 0,45 мкм. Она представлена преимущественно железосодержащими минералами, гидратом оксида железа и соединениями железа, сорбированными на взвесях. Истинно растворенную и коллоидную форму обычно рассматривают совместно. Растворенное железо представлено соединениями, находящимися в ионной форме, в виде гидроксокомплексов и комплексов с растворенными неорганическими и органическими веществами природных вод. В ионной форме мигрирует главным образом Fe(II), а Fe(III) в отсутствии комплексообразующих веществ не может в значительных количествах находиться в растворенном состоянии.
В результате химического и биохимического (при участии железобактерий) окисления Fe(II) переходит в Fe(III), которое, гидролизуясь, выпадает в осадок в виде Fe(OH)3. Как для Fе(II), так и для Fe(III) характерна склонность к образованию гидроксокомплексов типа [Fe(OH)2]+, [Fe2(OH)2]4+, [Fe2(OH)3]3+, [Fe(OH)3]- и других, сосуществующих в растворе в разных концентрациях в зависимости от рН и в целом определяющих состояние системы железо-гидроксил. Основной формой нахождения Fe(III) в поверхностных водах являются его комплексные соединения с растворенными неорганическими и органическими соединениями, главным образом гумусовыми веществами. При рН 8,0 основной формой является Fe(OH)3. Коллоидная форма железа наименее изучена, она представляет собой гидрат оксида железа Fe(OH)3 и комплексы с органическими веществами.
Содержание железа в поверхностных водах суши составляет десятые доли миллиграмма в 1 л, вблизи болот — единицы миллиграммов в 1 л. Повышенное содержание железа наблюдается в болотных водах, в которых оно находится в виде комплексов с солями гуминовых кислот — гуматами. Наибольшие концентрации железа (до нескольких десятков и сотен миллиграммов в 1 л) наблюдаются в подземных водах с низкими значениями рН.
Являясь биологически активным элементом, железо в определенной степени влияет на интенсивность развития фитопланктона и качественный состав микрофлоры в водоеме.
Концентрация железа подвержена заметным сезонным колебаниям. Обычно в водоемах с высокой биологической продуктивностью в период летней и зимней стагнации заметно увеличение концентрации железа в придонных слоях воды. Осенне-весеннее перемешивание водных масс (гомотермия) сопровождается окислением Fe(II) в Fе(III) и выпадением последнего в виде Fe(OH)3.
Поскольку соединения железа в воде могут существовать в различных формах как в растворе, так и во взвешенных частицах, точнее результаты могут быть получены только при определении суммарного железа во всех его формах, так называемого общего железа.
Перевод железа в растворимую форму, пригодную для анализа, проводят, добавляя к пробе определенное количество сильной кислоты (HNO3, HCl, H2SO4) до рН 1 – 2.
Определение железа основано на способности железа(II) в интервале рН 3–9 образовывать с орто-фенантролином комплексное оранжево–красное соединение:
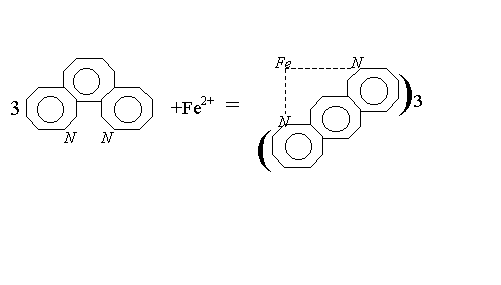
При наличии в воде железа(III), его восстанавливают до железа(II) солянокислым гидроксиламином в нейтральной или cлабокислой среде по реакции:
Fe3+ + 2NH2OH HCl = Fe2+ + N2 + 2H2O + 2HCl + 2H+.
Метод практически селективен при анализе природных поверхностных вод и питьевой воды.
Мешают: Cu и Co 5 мг/л, Ni 2 мг/л, Mn 50 мг/л, большое количество CN-, NO2-, PO43-.
Содержание железа в воде выше 1-2 мг Fe/л значительно ухудшает органолептические свойства, придавая ей неприятный вяжущий вкус, и делает воду малопригодной для использования в технических целях.
ПДК железа составляет 0,3 мг Fe/л (лимитирующий показатель вредности — органолептический).
Сумма тяжелых металлов
Говоря о повышенной концентрации в воде металлов, как правило, подразумевают ее загрязнение тяжелыми металлами (Cd, Pb, Zn, Cr, Ni, Co, Hg и др.). Тяжелые металлы, попадая в воду, могут существовать в виде токсичных растворимых солей и комплексных соединений, коллоидных частиц, осадков.
Главными источниками загрязнения воды тяжелыми металлами являются гальванические производства, предприятия горнорудной, черной и цветной металлургии, машиностроительные заводы и др. тяжелые металлы в воде вызывают целый ряд негативных последствий: попадая в пищевые цепи и нарушая элементный состав биологических тканей, они оказывают тем самым прямое или косвенное токсическое воздействие на водные организмы. Тяжелые металлы по пищевым цепям попадают в организм человека.
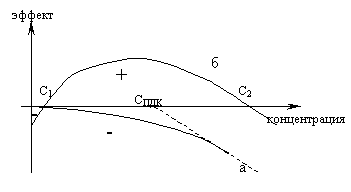
Тяжелые металлы по характеру биологического воздействия можно подразделить на токсиканты и микроэлементы, имеющие принципиально различный характер влияния на живые организмы.
Характер эффекта, оказываемого элементом на организм, в зависимости от его концентрации в воде: а – токсиканты, б – микроэлементы.
Токсиканты оказывают отрицательное действие на организмы при любой концентрации. В то время как микроэлементы имеют область недостаточности, вызывающей отрицательный эффект (менее С1), и область необходимых для жизни концентраций, при повышении которых снова возникает отрицательный эффект (более С2). Типичными токсикантами являются Cd, Pb, Hg, микроэлементами - Mn, Cu, Co.
Медь является микроэлементом. Содержится в организме человека, главным образом в виде комплексных органических соединений и играет важную роль в процессах кроветворения. Во вредном воздействии избытка меди решающую роль играет реакция катионов Cu2+ с SH – группами ферментов. Изменения содержания меди в сыворотке и коже обуславливает явление депигментации кожи. Отравления соединениями меди могут приводит к расстройствам нервной системы, нарушениям функций печени и почек и т. п. ПДК меди в воде водоемовхозяйственно – питьевого и культурно–бытового назначения составляет 1,0 мг/л, лимитирующий показатель вредности – органолептический.
Цинк является микроэлементом и водит в состав некоторых ферментов. Он содержится в крови (0,5 – 0,6), мягкий тканях (0,7 – 5,4), костях (10 – 18), волосах (16 – 22) ·10-3%, т. е. в основном, в костях и волосах.
Находится в организме в динамическом равновесии, которое сдвигается в условиях повышенных концентраций в окружающей среде. Отрицательное воздействие соединений цинка может выражаться в ослаблении организма, повышенной заболеваемости, астомоподобных явлениях и пр. ПДК цинка в воде водоемов составляет 1,0 мг/л, лимитирующий показатель вредности – обще санитарный.
Кадмий. Соединения кадмия очень ядовиты. Действуют на многие системы организма – органы дыхания и желудочно–кишечный тракт, центральную и периферическую нервные системы. Механизм действия соединений кадмия заключается в угнетении активности ряда ферментов, нарушении фосфорно–кальциевого обмена, нарушении метаболизма микроэлементов (Zn, Cu, Fe, Mn, Se). ПДК в воде водоемов составляет 0,001 мг/л, лимитирующий показатель вредности – санитарно-токсикологический.
Ртуть. Ртуть относится к ультрамикроэлементам и постоянно присутствует в организме, поступая с пищей. Неорганические соединения ртути (в первую очередь катионы Hg+) реагируют с SH–группами белков, а также с карбоксильными и аминными группами тканевых белков, образуя прочные комплексные соединения – металлопротеиды. В результате возникают глубокие нарушения функций центральной нервной системы, особенно высших ее отделов. Из органических соединений ртути наибольшее значение играет метилртуть, которая хорошо растворима в липидных тканях и быстро проникает в жизненно важные органы, и в том числе в мозг. В результате возникают изменения в вегетативной нервной системе, периферических нервных образованиях, в сердце, сосудах, кроветворных органах, печени, нарушения в иммунобиологическом состоянии организма. Соединения ртути обладают также эмбриотоксическим действиям (приводят к нарушению плода у беременных). ПДК – 0,0005 мг/л. Лимитирующий показатель вредности санитарно- токсикологический.
Свинец. Соединения свинца – яды, действующие на все живое, вызывающие изменения особенно в нервной системе, крови, сосудах. Подавляют многие ферментативные процессы. Дети более восприимчивы к воздействию соединений свинца, чем взрослые. Обладают эмбриотоксическим действием, приводят к энцефалопатии и поражениям печени, угнетают иммунитет. Органические соединения свинца (тетраметилсвинец, тетраэтилсвинец) – сильные нервные яды, летучие жидкости. Являются активными ингибиторами обменных процессов. Для всех соединений свинца характерно кумулятивное действие. ПДК 0,03 мг/л, лимитирующий показатель – санитарно – токсикологический.
Тяжелые металлы извлекают из раствора в виде их дитизонатных комплексов (экстракцией раствором дитизона в четыреххлористом углероде), избыток дитизона удаляют, полученную смесь дитизонатов обрабатывают солью ртути(II). Поскольку ртуть образует с дитизоном наиболее устойчивое комплексное соединение, дитизонаты всех перечисленных металлов превращаются в дитизонат ртути Hg (HDz)2. Измеряют оптическую плотность его раствора при λ = 485 нм. Проводят предварительное разрушение комплексных соединений тяжелых металлов. Fe3+ связывают тартратом натрия.
ПДК тяжелых металлов мэкв/л располагаются в следующем ряду: Cd (1,8·10-4),
Pb (9,7·10-4), Cu (3,1·10-3), Ni (3,4·10-3), Zn (3,1·10-2). Если найденное суммарное содержание тяжелых металлов превосходит первое из этих значений, приступают к определению содержания отдельных металлов, начиная с кадмия, вычитая из суммы найденный результат определения до тех пор, пока разность не окажется ниже ПДК следующего по порядку металла. ПДК Me= 0,001 ммоль/л.
Углерод органический
Органическое вещество сжигают «сухим» способом в токе кислорода (после выпаривания пробы) или «мокрым» способом – обработкой пробы окислителем (K2Cr2O7, CrO3, K2S2O8) в растворе H2SO4 в присутствии катализатора - Ag2SO4. Oбразующийся СО2 поглощают КОН или Ва(ОН)2 и заканчивают определение гравиметрически.
Общее содержание азота («общий азот») и азот органических веществ («органический азот»)
Метод Кьендаля: при нагревании органических веществ со смесью H2SO4 конц. и К2SO4 в присутствии катализатора – соли Сu Hg происходит разложение этих веществ с образованием сульфата аммония. Раствор подщелачивают, отгоняют аммиак и определяют его в отгоне. Вычитая из полученного результата отдельно найденное содержание азота аммонийного, получают «органический азот».
Общее содержание серы («общая сера»)
Определив общее содержание серы в сточной воде, можно затем отдельно определить серу сульфатов, сероводорода, уменьшая, таким образом, величину рассчитываемого по разности остатка.
Для определения общего содержания серы, прежде всего, окисляют все содержащее этот элемент вещества, сера при этом превращается в SO42-, затем определяют содержание последних (гравиметрически, комплексонометрически – обратное титрование с ЭДТА).
Окисление:
- кипячение с бромной водой,
- обработка бромом в присутствии CHCl3 CCl4.
|
|
Дата добавления: 2014-01-11; Просмотров: 507; Нарушение авторских прав?; Мы поможем в написании вашей работы!