
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изопарафинов олефинами
 |
Теоретические основы процессов алкилирования
В качестве алкилирующих агентов в промышленности применяют главным образом хлорпроизводные и олефины. Использование спиртов менее эффективно, потому что при алкилировании спиртами хлорид алюминия разлагается, а протонные кислоты разбавляются образующейся водой. В обоих случаях происходит дезактивирование катализатора, что обусловливает его большой расход.
Строение алкильной группы в полученном продукте определяется правилом о промежуточном образовании наиболее стабильного иона карбония (трет- > втор- > перв-). Поэтому в случае низших олефинов только из этилена образуется первичный алкилбензол (этилбензол), из пропилена — вторичный (изопропилбензол), а из изобутилена — трет- бутилбензол:
+H+ + +C6H6
СН2=CH2 → СН3−СН2 → С6Н5−СН2−СН3 + Н+
+H+ + +C6H6
СН3−СН=СН2 → СН3−СН−СН3 → С6H5−СН(СН3)2 + Н+
+H+ + +C6H6
(СН3)2C=СН2 → (СН3)3С → С6H5−С(СН3)3 + H+
Алкилирование изопарафинов олефинами применяется в промышленности главным образом для получения компонентов моторного топлива с высокой антидетонационной стойкостью.
CH3
|
CH3−CH−CH3 + CH2=CH2 ↔ CH3−C−CH2−CH3
| |
CH3 CH3
CH3
|
CH3−CH−CH3 + CH3−CH=CH−CH3 ↔ CH3−C−CH−CH2−CH3
| | \
CH3 CH3 CH3
Алкилирование изопарафинов олефинами – равновесный экзотермический процесс.
R'CH=CH2 + RH ↔ RR'CH−CH3 + Q
Реакцию можно осуществлять при нагревании и высоком давлении (термическое алкилирование) или с использованием катализаторов (каталитическое алкилирование). Катализаторы — серная кислота, фторид водорода, трифторид бора, хлорид алюминия). В присутствии кислых катализаторов процесс идет по ионному механизму, при этом в результате изомеризации карбкатионов образуется сложная смесь углеводородов.
|
|
|
В реакцию вступают любые олефины, труднее всего этилен, по мере удлинения и разветвления цепи реакционная способность олефинов возрастает.
Каталитическое алкилирование протекает при обычной температуре (или даже при охлаждении до 0 оС) и давлении, близком к атмосферному. В присутствии раствора серной кислоты 97 % мас. изопарафины легко реагируют с олефинами (кроме этилена) уже при температуре 20±5 оС.
Теоретические основы процессов алкилирования ароматических углеводородов. Влияние строения ароматического соединения при реакциях алкилирования в общем такое же, как при других процессах электрофильного замещения в ароматическое ядро, но имеет свои особенности. Реакция алкилирования отличается сравнительно малой чувствительностью к электронодонорным заместителям в ядре. Так, активирующее влияние алкильных групп и конденсированных ядер при катализе реакции хлоридом алюминия изменяется следующим образом (для бензола величина принята за 1):
С10Н8 > С6Н4(СН3)2 > С6Н5−СН3 > С6Н5−С2Н5 > С6Н5−СН(СН3)2 > С6Н6
3,5 3 2,2 1,8 1,4 1
нафталин ксилол толуол этилбензол изопропилбензол бензол
Электроноакцепторные заместители сильно дезактивируют ароматическое ядро. Хлорбензол алкилируется примерно в 10 раз медленнее бензола, а карбонильные (−СНО), карбоксильные (−СООН), циацо- (−С≡N) и нитротгруппы (−NO2) приводят к полному дезактивированию ароматического ядра, вследствие чего соответствующие производные вообще не способны к алкилированию. Этим реакция алкилирования значительно отличается от других процессов замещения в ароматическое ядро, например от хлорирования и сульфирования.
Правила ориентации при алкилировании в общем подобны другим реакциям электрофильного замещения в ароматическое ядро, но строение продукта может существенно изменяться в зависимости от катализаторов и условий реакции. Так, электронодонорные заместители и атомы галогена направляют дальнейшее замещение преимущественно в пара - и орто -положения, однако, в более жестких условиях и особенно при катализе хлоридом алюминия происходит изомеризация гомологов бензола с внутримолекулярной миграцией алкильных групп и образованием равновесных смесей, в которых преобладают термодинамически более стабильные изомеры. Реакция изомеризации ксилолов (где устанавливается равновесие между всеми тремя изомерами) в более ценные изомеры,
|
|
|
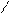



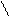

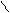
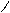

 CH3
CH3






 CH3 CH3 H3C СН3
CH3 CH3 H3C СН3
 H3C
H3C
орто- мета- пара-
но она протекает и с другими алкильными группами. При алкилировании нафталина это позволяет в мягких условиях получать 1-алкил-, а в более жестких — 2-алкилнафталин.
Алкилирование ароматических углеводородов — это сложный многостадийный процесс, состоящий из ряда взаимосвязанных реакций: алкилирование, изомеризации, переалкилирование, полимеризации, диспропорционирование, и др.
В качестве катализаторов процесса алкилирования могут быть использованы как протонные кислоты, так и кислоты Льюиса. Протонные кислоты широко применяются при алкилировании бензола олефинами и спиртами, причем их активность падает в ряду
HF > H2SO4 > H3PO4.
Кислоты Льюиса, используемые в качестве катализаторов алкилирования бензола, по своей активности могут быть расположены в следующем порядке:
AlBr3 > AlCl3 > FeCl3 > BF3 > TiCl3 > ZnCl2 > SnCl4 > TiCl4
При использовании в качестве алкилирующих агентов хлорпроизводных углеводородов катализаторами являются лишь кислоты Льюиса. Главным образом AlCl3, который активирует атом хлора с образованием поляризованного комплекса, а затем и карбкатиона. Поэтому реакционная способность хлоралкилов зависит от поляризации связи C−Cl (или от стабильности ионов карбония) и повышается с удлинением цепи и с разветвлением алкильной группы.
При алкилировании ароматических соединений в присутствии любых катализаторов происходит последовательное замещение атомов водорода с образованием смеси продуктов разной степени алкилирования. При умеренной температуре каждая стадия практически необратима.
+C2H4 +C2H4 +C2H4
|
|
|
C6H6 → C6H5C2H5 → C6H4(C2H5)2 +...+ → C6(C2H5)6
На AlCl3 и в жестких условиях происходит и обратная реакция переалкилирования (диспропорционирование) с межмолекулярной мигацией алкильных групп.
C6H4(C2H5)2 + C6H6 ↔ 2C6H5C2H5
Следовательно, в процессе на AlCl3 может устанавливаться равновесие, что важно учитывать при выборе условий процесса — оптимального мольного соотношения реагентов.
На протонных катализаторах состав продуктов определяется кинетикой процесса, на AlCl3 и в жестких условиях — равновесием.
При кинетическом режиме процесса, поскольку вторая стадия алкилирования протекает быстрее первой, максимальная мольная доля моноалкилбензола в смеси составляет только 25-30 %. Для повышения селективности приходится работать при мольном соотношении бензола и алкилирующего агента 10-20:1, идя на значительные затраты по отгонке и возвращению избыточного бензола на реакцию.
Для получения моноалкилбензола равновесный состав продуктов последовательного алкилирования значительно выгоднее, чем кинетический, мольная доля моноалкилбензола в смеси достигает 50 %. Кроме того, побочно получающиеся ди- и полиалкилбензолы можно возвращать на реакцию, где они будут при переалкилировании с бензолом превращаться в целевой продукт. Всё это значительно повышает селективность и позволяет работать при мольном соотношении бензола и алкилирующего агента 2-3:1, что значительно сокращает количество избыточного бензола и затраты на его отгонку и возвращение на реакцию.
Реакция алкилирования на хлориде алюминия идет очень быстро. В области, близкой к диффузионной, скорость сильно зависит от давления, перемешивания или интенсивности барботажа газообразного олефина, но мало — от температуры, так как имеет низкую энергию активации (30-40 кДж/моль). Процесс переалкилирования идет значительно медленнее и требует более высокой температуры, энергия активации выше (~63 кДж/моль).
По мере падения активности катализатора обе реакции замедляются и идет накопление полиалкилбензолов, которые связывают AlCl3 в довольно прочный σ-комплекс при низкой температуре. В силу этого наилучшей температурой при алкилировании бензола этиленом и пропиленом является 100-110 оС.
|
|
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1261; Нарушение авторских прав?; Мы поможем в написании вашей работы!