
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Внутренняя энергия
|
|
|
|
1) включает в себя энергию всевозможных видов движения и взаимодействия всех частиц (молекул, атомов, ионов и т. д.), образующих рассматриваемую систему.
Например, внутренняя энергия системы, находящейся в газообразном состоянии, состоит из:
а) кинетической энергии беспорядочного (теплового) поступательного и вращательного движения молекул, а также колебательного движения атомов в молекулах;
б) потенциальной энергии, обусловленной силами межмолекулярного взаимодействия;
в) энергии электронных оболочек атомов и ионов;
г) энергии движения и взаимодействия нуклонов в атомных ядрах.
2 ) является однозначной функцией состояния термодинамической системы. Значение внутренней энергии в каком-либо произвольно выбранном состоянии системы не зависит от того, каким образом система пришла в это состояние. Иначе говоря, изменение внутренней энергии 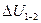 при переходе системы из состояния 1 в состояние 2 не зависит от вида процесса перехода и равно
при переходе системы из состояния 1 в состояние 2 не зависит от вида процесса перехода и равно
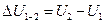 (5)
(5)
В частности, если в результате какого-либо процесса система возвращается в исходное состояние, то полное изменение внутренней энергии равно нулю.

 Действительно, рассмотрим круговой процесс 1-2-1 (рис.1). Полное изменение внутренней энергии
Действительно, рассмотрим круговой процесс 1-2-1 (рис.1). Полное изменение внутренней энергии
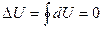 . (6)
. (6)
(Если бы 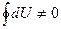 , то в данном состоянии внутренняя энергия могла бы иметь различные значения. Это позволило бы без изменения состояния системы получить работу, равную разности энергий, что невозможно).
, то в данном состоянии внутренняя энергия могла бы иметь различные значения. Это позволило бы без изменения состояния системы получить работу, равную разности энергий, что невозможно).
Из выражения (5) видно, что изменение энергии при переходе системы из состояния 1 в состояние 2
· не зависит от пути перехода,
· определяется только свойствами системы в состоянии 1 и 2.
Поэтому U является функцией состояния.
3) определяется подобно потенциальной энергии в механикетолько с точностью до постоянного слагаемого Uo, зависящего от выбора «начала отсчета» внутренней энергии, т. е. от выбора состояния, в котором внутренняя энергия принимается равной нулю. Так как во всех термодинамических расчетах определяются не абсолютные значения внутренней энергии U, а ее изменения 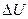 , не зависящие от Uo, то выбор Uo не играет роли.
, не зависящие от Uo, то выбор Uo не играет роли.
|
|
|
Во всех процессах, не связанных с химическими реакциями и другими превращениями электронных оболочек атомов и ионов, а также с ядерными реакциями, составляющие в) и г) внутренней энергии не изменяются и их можно не включать во внутреннюю энергию. Поэтому в дальнейшем, рассматривая, например, внутреннюю энергию
· газа, мы будем под ней понимать только сумму кинетической энергии теплового движения молекул (поступательного, вращательного и колебательного) и потенциальную энергию межмолекулярного взаимодействия.
· в идеальном газе, т.к. пренебрегают силами межмолекулярного взаимодействия на расстоянии, то можно считать равной сумме кинетических энергий беспорядочного движения всех молекул.
· кристаллического диэлектрика нужно учитывать кинетическую и потенциальную энергию, связанную с тепловыми колебаниями атомов, молекул или ионов, образующих этот кристаллический диэлектрик.
· металла включает в себя не только энергию тепловых колебаний ионов, но также и энергию теплового движения электронов проводимости
Число независимых величин полностью определяющих положение точки в пространстве, называется числом степеней свободы. (в пространстве – 3, на плоскости – 2, на прямой – 1)
Прибегая к модели идеального газа, мы пренебрегаем потенциальной энергией взаимодействия молекул, поэтому внутренняя энергия идеального газа равна кинетической энергии всех его молекул.
Согласно принципу равнораспределения энергии по степеням свободы, кинетическая энергия молекулы идеального газа равна
|
|
|
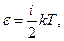
где i – число степеней свободы молекулы.
Тогда внутренняя энергия некоторой массы газа равна
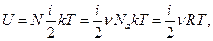 (7)
(7)
где 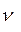 - количество вещества данного газа,
- количество вещества данного газа,
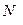 - число его молекул,
- число его молекул,
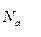 - число Авогадро (количество молекул, содержащееся в моле вещества),
- число Авогадро (количество молекул, содержащееся в моле вещества),
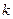 - постоянная Больцмана,
- постоянная Больцмана,
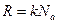 - универсальная газовая постоянная.
- универсальная газовая постоянная.
Последнее выражение показывает, что внутренняя энергия является функцией температуры.
Выражение для внутренней энергии, казалось бы, подтверждает гипотезу о равнораспределении молекул по степеням свободы. Однако расширение температурного интервала показывает иное. Вообще говоря, изначально эта гипотеза была не очень понятна: почему, например, двухатомная молекула не может вращаться вокруг своей оси, или почему «жесткая» молекула не испытывает колебаний. В истории физики имеет место следующий парадокс. Успех гипотезы о равнораспределении энергии по степеням свободы связан с отказом от этой гипотезы. Успех был основан на том, что некоторые степени искусственно исключались без каких-либо убедительных оснований, и множество степеней свободы молекулы просто игнорировалось.
Все эти вопросы были разрешены в рамках квантовой механики.
Известно, что вращательная и колебательная энергии молекулы квантованы. Их уровни энергии
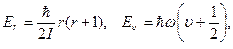 (8)
(8)
где r – вращательное квантовое число (r= 0,1,2,3…),
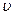 - колебательное квантовое число, (
- колебательное квантовое число, (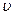 = 0,1,2,3…),
= 0,1,2,3…),
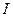 - момент инерции молекулы относительно той или иной главной оси,
- момент инерции молекулы относительно той или иной главной оси,
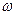 - собственная частота колебаний,
- собственная частота колебаний,
 - постоянная Планка.
- постоянная Планка.
Минимальная вращательная энергия молекулы водорода, рассчитанная по этим формулам, составляет порядка 0,01эВ, при низких температурах (~50К) средняя энергия поступательного движения молекулы вдвое меньше минимальной вращательной энергии, т.е. ее оказывается недостаточно, чтобы возбудить вращательные степени свободы. В этих условиях говорят, что вращательные степени свободы «заморожены».
В области температур ~500К вращательные степени свободы полностью разморожены, и молекула водорода ведет себя как жесткая двухатомная молекула с числом степеней свобода 5=3+2. При этом включаются две, а не три вращательные степени свободы, Это связано с тем, что для включения степени свободы, соответствующей вращению молекулы вокруг ее оси, проходящей через оба ядра, требуется значительно большая энергия из-за малости момента инерции молекулы относительно этой оси.
|
|
|
При температурах, превышающих 1000 К, энергии уже оказывается достаточно для постепенного возбуждения колебательной степени свободы.
3.4. Работа и теплота.
Обмен энергией между закрытой термодинамической системой и внешними телами может осуществляться двумя качественно различными способами: путем совершения работы и путем теплообмена (конвективного теплообмена, теплопроводности, теплообмена излучением).
Первый способ осуществляется при силовом взаимодействии между телами.
Энергия, передаваемая при этом рассматриваемой термодинамической системе внешними телами, называется работой, совершаемой над системой (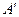 ).
).
Энергия, передаваемая системе внешними телами, путем теплообмена, называется теплотой, получаемой системой от внешней среды.
В термодинамике процесс изменения энергии макроскопической системы при изменении внешних параметров называется работой.
Работу над системой производят внешние силы. Для совершения работы над макроскопической неподвижной системой нужно, чтобы перемещались взаимодействующие с ней внешние тела, т.е. чтобы изменялись внешние параметры системы.
В отсутствии внешних силовых полей обмен энергией между неподвижной системой и внешней средой может осуществляться путем совершения работы лишь в процессе изменения объема и формы системы (например, так ведет себя поршень в цилиндре с газом).
Работа 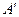 , совершаемая внешними телами над системой численно равна и противоположна по знаку А работе, совершаемой самой системой над внешней средой, т.е. против внешних сил.
, совершаемая внешними телами над системой численно равна и противоположна по знаку А работе, совершаемой самой системой над внешней средой, т.е. против внешних сил.
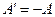 (9)
(9)
В отличие от внутренней энергии системы, которая является однозначной функцией состояния этой системы, понятие теплоты и работы имеют смысл только в связи с процессом изменения состояния системы. Они являются энергетическими характеристиками этого процесса.
|
|
|
Работа и теплота - характеристики процесса изменения энергии, для их определения надо знать не только переходные и конечные состояния системы, но и все промежуточные состояния процесса, поэтому они не являются функциями состояния.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1362; Нарушение авторских прав?; Мы поможем в написании вашей работы!