
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общая характеристика р-элементов VIА-группы. Халькогены
|
|
|
|
 В VIА-группу периодической системы элементов Д.И. Менделеева входят кислород, сера, селен, теллур, полоний. Первые четыре из них имеют неметаллический характер. Общее название элементов этой группы халькогены, что в переводе с греч. означает «образующие руды», указывая на их нахождение в природе.
В VIА-группу периодической системы элементов Д.И. Менделеева входят кислород, сера, селен, теллур, полоний. Первые четыре из них имеют неметаллический характер. Общее название элементов этой группы халькогены, что в переводе с греч. означает «образующие руды», указывая на их нахождение в природе.
 Электронная формула валентной оболочки атомов элементов VIА-группы.
Электронная формула валентной оболочки атомов элементов VIА-группы.
Атомы этих элементов имеют по 6 валентных электронов на s- и р-орбиталях внешнего энергетического уровня. Из них две р-орбитали заполнены наполовину.
Атом кислорода отличается от атомов других халькогенов отсутствием низколежащего d-подуровня. Поэтому кислород, как правило, способен образовывать только две связи с атомами других элементов. Однако в некоторых случаях наличие неподеленных пар электронов на внешнем энергетическом уровне позволяет атому кислорода образовывать дополнительные связи по донорно-акцепторному механизму.
 У атомов остальных халькогенов при поступлении энергии извне число неспаренных электронов может увеличиваться в результате перехода s- и р-электронов на d-подуровень. Поэтому атомы серы и других халькогенов способны образовывать не только 2, но также и 4, и 6 связей с атомами других элементов. Например, у атома серы в возбужденном состоянии электроны внешнего энергетического уровня могут приобретать электронную конфигурацию 3s23р33d1 и 3s13р33d2:
У атомов остальных халькогенов при поступлении энергии извне число неспаренных электронов может увеличиваться в результате перехода s- и р-электронов на d-подуровень. Поэтому атомы серы и других халькогенов способны образовывать не только 2, но также и 4, и 6 связей с атомами других элементов. Например, у атома серы в возбужденном состоянии электроны внешнего энергетического уровня могут приобретать электронную конфигурацию 3s23р33d1 и 3s13р33d2:
В зависимости от состояния электронной оболочки проявляются разные степени окисления (СО). В соединениях с металлами и водородом элементы этой группы проявляют СО = —2. В соединениях же с кислородом и неметаллами сера, селен и теллур могут иметь СО = +4 и СО = +6. В некоторых соединениях они проявляют СО = +2.
|
|
|
Кислород уступает по электроотрицательности только фтору. Во фтороксиде F2О степень окисления кислорода положительна и равна +2. С остальными элементами кислород проявляет обычно в соединениях степень окисления -2, за исключением пероксида водорода Н2О2 и его производных, в которых кислород имеет степень окисления —1. В живых организмах кислород, сера и селен входят в состав биомолекул в степени окисления —2.
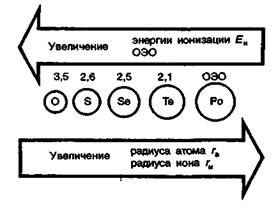 В ряду О — S — Sе—Те — Ро увеличиваются радиусы атомов и ионов. Соответственно в этом же направлении закономерно понижается энергия ионизации и относительная электроотрицательность.
В ряду О — S — Sе—Те — Ро увеличиваются радиусы атомов и ионов. Соответственно в этом же направлении закономерно понижается энергия ионизации и относительная электроотрицательность.
С увеличением порядкового номера элементов VIА-группы окислительная активность нейтральных атомов понижается и увеличивается восстановительная активность отрицательных ионов. Все это приводит к ослаблению неметаллических свойств халькогенов при переходе от кислорода к теллуру.
С увеличением порядкового номера халькогенов возрастают характерные координационные числа. Это связано с тем, что при переходе от р-элементов четвертого периода к р-элементам пятого и шестого периодов в образовании σ- и π-связей все большую роль начинают играть d - и даже f-орбитали. Так, если для серы и селена наиболее характерны координационные числа 3 и 4, то для теллура — 6 и даже 8.
 В нормальных условиях водородные соединения H2Э элементов VIА-группы, за исключением воды, — газы с очень неприятным запахом. Термодинамическая стабильность этих соединений уменьшается от воды к водородтеллуриду Н2Те. В водных растворах они проявляют слабокислотные свойства. В ряду H2О—H2S—H2Sе— H2Те сила кислот возрастает.
В нормальных условиях водородные соединения H2Э элементов VIА-группы, за исключением воды, — газы с очень неприятным запахом. Термодинамическая стабильность этих соединений уменьшается от воды к водородтеллуриду Н2Те. В водных растворах они проявляют слабокислотные свойства. В ряду H2О—H2S—H2Sе— H2Те сила кислот возрастает.
 Это объясняется увеличением радиусов ионов Э2- и соответствующим ослаблением связей Э—Н. В том же направлении растет восстановительная способность H2Э.
Это объясняется увеличением радиусов ионов Э2- и соответствующим ослаблением связей Э—Н. В том же направлении растет восстановительная способность H2Э.
Сера, селен, теллур образуют два ряда кислотных оксидов: ЭO2 и ЭО3. Им соответствуют кислотные гидроксиды состава H2ЭО3 и H2ЭО4. Кислоты H2ЭО3 в свободном состоянии неустойчивы. Соли этих кислот и сами кислоты проявляют окислительно-восстановительную двойственность, так как элементы S, Sе и Те имеют в этих соединениях промежуточную степень окисления + 4.
|
|
|
Кислоты состава Н2ЭО4 более устойчивы и в реакциях ведут себя как окислители (высшая степень окисления элемента +6).
Химические свойства соединений кислорода. Кислород — самый распространенный элемент в земной коре (49,4%). Высокое содержание и большая химическая активность кислорода определяют преобладающую форму существования большинства элементов Земли в виде кислородсодержащих соединений. Кислород входит в состав всех жизненно важных органических веществ — белков, жиров, углеводов.
Без кислорода невозможны многочисленные чрезвычайно важные жизненные процессы, например дыхание, окисление аминокислот, жиров, углеводов. Только немногие растения, называемые анаэробными, могут обходиться без кислорода.
У высших животных (рис. 8.7) кислород проникает в кровь, соединяется с гемоглобином, образуя легко диссоциирующее соединение оксигемоглобин. С потоком крови это соединение поступает в капилляры различных органов. Здесь кислород отщепляется от гемоглобина и через стенки капилляров диффундирует в ткани. Связь между гемоглобином и кислородом непрочная и осуществляется за счет донорно-акцепторного взаимодействия с ионом Fе2+.
В состоянии покоя человек вдыхает примерно 0,5м3 воздуха в час. Но лишь 1/5 ч. вдыхаемого с воздухом кислорода удерживается в организме. Однако избыток кислорода (4/5) необходим для создания высокой его концентрации в крови. Это в соответствии с законом Фика обеспечивает достаточную скорость диффузии кислорода через стенки капилляров. Таким образом, за сутки человек фактически использует около 0,1м3 кислорода.
В тканях кислород расходуется. на окисление различных веществ. Эти реакции в конечном счете приводят к образованию углерода диоксида, воды и созданию запаса энергии.
Кислород расходуется не только в процессе дыхания, но и в процессе гниения растительных и животных остатков. В результате процесса гниения сложных органических веществ образуются их продукты окисления: СО2, Н2О и др. Регенерация кислорода совершается в растениях.
|
|
|
Таким образом, в результате круговорота кислорода в природе поддерживается его постоянное содержание в атмосфере. Естественно, что круговорот кислорода в природе тесно связан с круговоротом углерода (рис. 8.8).
Элемент кислород существует в виде двух простых веществ (аллотропные модификации): дикислорода (кислорода) О2 и трикислорода (озона) О3. В атмосфере практически весь кислород содержится в виде кислорода О2, содержание же озона очень мало. Максимальная объемная доля озона на высоте 22км составляет всего лишь 10-6%.
Молекула кислорода О2 в отсутствие других веществ очень стабильна. Наличие в молекуле двух неспаренных электронов обусловливает ее высокую реакционную способность. Кислород — один из самых активных неметаллов. С большинством простых веществ он реагирует непосредственно, образуя оксиды ЭxOy Степень окисления кислорода в них равна —2. В соответствии с изменением структуры электронных оболочек атомов характер химической связи, а следовательно, структура и свойства оксидов в периодах и группах системы элементов изменяются закономерно. Так, в ряду оксидов элементов второго периода Li2О—ВеО—B2О3—СО2—N2O5 полярность химической связи Э—О от I к V группе постепенно уменьшается. В соответствии с этим ослабляются основные и усиливаются кислотные свойства: Li2О — типичный основной оксид, ВеО — амфотерный, а B2О3, СО2 и N2O5 — кислотные оксиды. Аналогично изменяются кислотно-основные свойства и в других периодах.
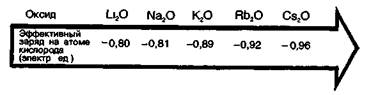 В главных подгруппах (А-группах) с увеличением порядкового номера элемента ионность связи Э—О в оксидах обычно увеличивается.
В главных подгруппах (А-группах) с увеличением порядкового номера элемента ионность связи Э—О в оксидах обычно увеличивается.
Соответственно основные свойства оксидов в группе Li—Nа—К—Rb—Сs и других А-группах возрастают.
Свойства оксидов, обусловленные изменением характера химической связи, представляют собой периодическую функцию заряда ядра атома элемента. Об этом свидетельствует, например, изменение по периодам и группам температур плавления, энтальпий образования оксидов в зависимости от заряда ядра.
|
|
|
Полярность связи Э—ОН в гидроксидах Э(ОН)n, а следовательно, и свойства гидроксидов закономерно изменяются по группам и периодам системы элементов.
Например, в IА-, IIА- и IIIА-группах сверху вниз с увеличением радиусов ионов полярность связи Э—ОН возрастает. В результате в воде легче идет ионизация Э—ОН → Э+ + ОН-. Соответственно усиливаются основные свойства гидроксидов. Так, в группе IА основные свойства гидроксидов щелочных металлов усиливаются в ряду Li—Nа—К—Rb—Сs.
В периодах слева направо с уменьшением ионных радиусов и увеличением заряда иона полярность связи Э—ОН уменьшается. В результате в воде легче идет ионизация ЭОН ⇄ ЭО- + Н+. Соответственно в этом направлении усиливаются кислотные свойства. Так, в пятом периоде гидроксиды RbОН и Sr(ОН)2 являются основаниями, In(ОН)3 и Sn(ОН)4 — амфотерными соединениями, а Н[Sb(ОН)6] и Н6ТеО6 — кислотами.
Наиболее распространенный на земле оксид — водород оксид или вода. Достаточно сказать, что она составляет 50—99% массы любого живого существа. В организме человека содержится 70—80% воды. За 70 лет жизни человек выпивает около 25 000 кг воды.
Благодаря своей структуре вода обладает уникальными свойствами. В живом организме она является растворителем органических и неорганических соединений, участвует в процессах ионизации молекул растворенных веществ. Вода является не только средой, в которой протекают биохимические реакции, но и сама интенсивно участвует в гидролитических процессах.
Жизненно важна способность кислорода к образованию оксигенильных комплексов с различными веществами. Ранее рассмотрены примеры оксигенильных комплексов О2 с ионами металлов — переносчиков кислорода в живых организмах — оксигемоглобин и оксигемоцианин:
НbFе2+ + О2 → НbFе2+∙О2
НсСu2+ + О2 → НсСu2+∙О2
где Нb — гемоглобин, Нc — гемоцианин.
Имея две неподеленные пары электронов, кислород выступает в качестве донора в этих координационных соединениях с ионами металлов. В других соединениях кислород образует различные водородные связи.
В настоящее время большое внимание уделяется получению оксигенильных комплексов переходных металлов, которые могли бы выполнять функции, сходные с функциями соответствующих бионеорганических комплексных соединений. Состав внутренней координационной сферы этих комплексов аналогичен природным активным центрам. В частности, перспективными по способности обратимо присоединять и отдавать элементный кислород являются комплексы кобальта с аминокислотами и некоторыми другими лигандами. Эти соединения в известной степени можно рассматривать как заменители гемоглобина.
Одной из аллотропных модификаций кислорода является озон О3. По своим свойствам озон сильно отличается от кислорода О2 — имеет более высокие температуры плавления и кипения, обладает резким запахом (отсюда его название).
Образование озона из кислорода сопровождается поглощением энергии:
3О2 ⇄ 2О3,
Озон получают при действии электрического разряда в кислороде. Образуется озон из О2 и под действием ультрафиолетового излучения. Поэтому при работе бактерицидных и физиотерапевтических ультрафиолетовых ламп чувствуется запах озона.
Озон — сильнейший окислитель. Окисляет металлы, бурно реагирует с органическими веществами, при низкой температуре окисляет соединения, с которыми кислород не реагирует:
О3 + 2Аg = Аg2О + О2
РbS + 4О3 = РbSО4 + 4O2
Широко известна качественная реакция:
2КI + О3 + Н2О = I2 + 2КОН + О2
Окислительное действие озона на органические вещества связано с образованием радикалов:
RН + О3 → RО2 ∙ + ОН ∙
 Радикалы инициируют радикально-цепные реакции с биоорганическими молекулами — липидами, белками, ДНК. Такие реакции приводят к повреждению и гибели клеток. В частности, озон убивает микроорганизмы, содержащиеся в воздухе и воде. На этом основано применение озона для стерилизации питьевой воды и воды плавательных бассейнов.
Радикалы инициируют радикально-цепные реакции с биоорганическими молекулами — липидами, белками, ДНК. Такие реакции приводят к повреждению и гибели клеток. В частности, озон убивает микроорганизмы, содержащиеся в воздухе и воде. На этом основано применение озона для стерилизации питьевой воды и воды плавательных бассейнов.
Химические свойства соединений серы. По своим свойствам сера близка к кислороду. Но в отличие от него она проявляет в соединениях не только степень окисления —2, но и положительные степени окисления +2, +4 и +6. Для серы, как и для кислорода, характерна аллотропия — существование нескольких элементных веществ — ромбической, моноклинной, пластической серы. Вследствие меньшей электроотрицательности по сравнению с кислородом способность к образованию водородных связей у серы выражена слабее. Для серы характерно образование устойчивых полимерных гомоцепей, имеющих зигзагообразную форму.
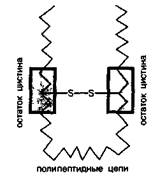
Образование гомоцепей из атомов серы характерно и для ее соединений, выполняющих существенную биологическую роль в процессах жизнедеятельности. Так, в молекулах аминокислоты — цистина имеется дисульфидный мостик —S—S—:

Эта аминокислота играет важную роль в формировании белков и пептидов. Благодаря дисульфидной связи S—S полипептидные цепи оказываются скрепленными между собой (дисульфидный мостик).
 Характерно для серы и образование водородсульфидной (сульфгидрильной) тиоловой группы —SН, которая присутствует в аминокислоте цистеине, белках, ферментах.
Характерно для серы и образование водородсульфидной (сульфгидрильной) тиоловой группы —SН, которая присутствует в аминокислоте цистеине, белках, ферментах.
Очень важной в биологическом отношении является аминокислота метионин.
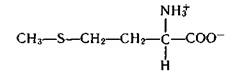
Донором метильных групп в живых организмах служит S-аденозилметионин Аd—S—СН3 — активированная форма метионина, в которой метильная группа соединена через S с аденином Аd. Метильная группа метионина в процессах биосинтеза переносится на различные акцепторы метильных групп RН:
Аd—S—СН3 + RН → Аd—SН + R—СН3
Сера довольно широко распространена на Земле (0,03%). В природе присутствует в виде сульфидных (ZnS, НgS, РbS и др.) и сульфатных (Nа2SО4∙10Н2О, СаSО4∙2Н2О и др.) минералов, а также в самородном состоянии. Порошок «серы осажденной» применяют наружно в виде мазей (5—10—20%) и присыпок при лечении кожных заболеваний (себореи, псориаза). В организме образуются продукты окисления серы — политионовые кислоты с общей формулой H2SxO6 (х = 3—6)
S + O2 → H2SxO6
Эти продукты обладают противомикробной и противопаразитарной активностью. Таков же механизм действия серы очищенной, применяемой в качестве противоглистного средства.
Сера — довольно активный неметалл. Даже при небольшом нагревании она окисляет многие простые вещества, однако и сама легко окисляется кислородом и галогенами (окислительно-восстановительная двойственность).
Степень окисления —2 сера проявляет в сероводороде и его производных — сульфидах.
Сероводород (диводородсульфид) часто встречается в природе. Содержится в так называемых серных минеральных водах. Это бесцветный газ с неприятным запахом. Образуется при гниении растительных и, в особенности, животных остатков под действием микроорганизмов. Некоторые фотосинтезирующие бактерии, например зеленые серные бактерии, в качестве донора водорода используют диводородсульфид. Эти бактерии вместо кислорода О2 выделяют элементную серу — продукт окисления Н2S.
Диводородсульфид — весьма токсичное вещество, так как является ингибитором фермента цитохромоксидазы — переносчика электронов в дыхательной цепи. Он блокирует перенос электронов с цитохромоксидазы на кислород О2.
Водные растворы Н2S дают слабокислую реакцию по лакмусу. Происходит ионизация по двум ступеням:
Н2S ⇄ Н+ + НS- (I ступень)
НS- ⇄ Н+ + S2- (II ступень)
Сероводородная кислота очень слабая. Поэтому ионизация по второй ступени протекает только в очень разбавленных растворах.
Соли сероводородной кислоты называются сульфидами. В воде растворимы сульфиды только щелочных, щелочноземельных металлов и аммония. Кислые соли — гидросульфиды Э+НS и Э2+(НS)2 — известны только для щелочных и щелочноземельных металлов
Являясь солями слабой кислоты, сульфиды подвергаются гидролизу. Гидролиз сульфидов многозарядных катионов металлов (Аl3+, Сr3+ и др.) часто доходит до конца, он практически необратим.
Сульфиды, в особенности сероводород, являются сильными восстановителями. В зависимости от условий они могут окисляться до S, SО2 или Н2SО4:
2Н2S + 3О2 = 2SО2 + 2Н2О (на воздухе)
2Н2S + О2 = 2Н2О + 2S (на воздухе)
3Н2S + 4НСlO3 = 3Н2SО4 + 4НСl (в растворе)
Некоторые белки, содержащие цистеин НSСН2СН(NН2)СООН и важный метаболит кофермент А, имеющие водородсульфидные (тиоловые) группы —SН, в ряде реакций ведут себя как бионеорганические производные диводородсульфида. Белки, содержащие цистеин, так же, как и диводородсульфид, можно окислить иодом. При помощи дисульфидного мостика, образующегося при окислении тиоловых групп, цистеиновые остатки полипептидных цепей соединяют эти цепи поперечной связью (образуется сшивка).
 Многие серосодержащие ферменты Е—SН необратимо отравляются ионами тяжелых металлов, такими, как Сu2+ или Аg+. Эти ионы блокируют тиольные группы с образованием меркаптанов, бионеорганических аналогов сульфидов:
Многие серосодержащие ферменты Е—SН необратимо отравляются ионами тяжелых металлов, такими, как Сu2+ или Аg+. Эти ионы блокируют тиольные группы с образованием меркаптанов, бионеорганических аналогов сульфидов:
Е—SН + Аg+ → Е—S—Аg + Н+
В результате фермент теряет активность. Сродство ионов Аg+ к тиольным группам настолько велико, что АgNО3 можно использовать для количественного определения —SН-групп методом титрования.
Оксид серы (IV) SO2 является кислотным оксидом. Его получают сжиганием элементной серы в кислороде или обжигом пирита FеS2:
S + О2 = SО2
4FеS2 + 11О2 = 2Fе2О3 + 8SО2
SО2 — газ с удушливым запахом; весьма ядовит. При растворении SО2 в воде образуется сернистая кислота Н2SО3. Эта кислота средней силы. Сернистая кислота, будучи двухосновной, образует соли двух типов: средние — сульфиты (Nа2SО3, К2SО3 и др.) и кислые — гидросульфиты (NаНSО3, КНSО3 и др.). В воде растворимы лишь соли щелочных металлов и гидросульфиты типа Э2+(НSО3)2, где Э — элементы различных групп.
Для оксида SО2, кислоты Н2SОз и ее солей характерна окислительно-восстановительная двойственность, так как сера имеет в этих соединениях промежуточную степень окисления +4:
2Nа2SО3 + О2 = 2Nа2SО4
SО2 + 2Н2S = 3S° + 2Н2O
Однако восстановительные свойства у соединений серы (IV) преобладают. Так, сульфиты в растворах окисляются даже дикислородом воздуха при комнатной температуре.
На высших животных оксид SO2 действует прежде всего как раздражитель слизистой оболочки дыхательных путей. Токсичен этот газ и для растений. В промышленных районах, где сжигается много угля, содержащего небольшое количество соединений серы, в атмосферу выделяется сера диоксид. Растворяясь во влаге, находящейся на листьях, SО2 образует раствор сернистой кислоты, который, в свою очередь, окисляется до серной кислоты Н2SО4:
SО2 + Н2О = Н2SО3
2Н2SО3 + О2 = 2Н2SО4
Атмосферная влага с растворенными SО2 и Н2SО4 выпадает нередко в виде кислотных дождей, приводящих к гибели растительности.
При нагревании раствора Nа2SО3 с порошком серы образуется натрий тиосульфат:
Nа2SО3 + S = Nа2S2О3
Из раствора выделяется кристаллогидрат Nа2S2О3∙5Н2О. Натрий тиосульфат — соль тиосерной кислоты Н2S2О3.
Тиосерная кислота очень неустойчива и разлагается на Н2О, SО2 и S. Натрий тиосульфат Nа2S2О3∙5Н2О применяют в медицинской практике как противотоксическое, противовоспалительное и десенсибилизирующее средство. Как противотоксическое средство, натрий тиосульфат используют при отравлениях соединениями ртути, свинца, синильной кислотой и ее солями. Механизм действия препарата, очевидно, связан с окислением тиосульфат-иона до сульфит-иона и элементной серы:
S2О32- → SО32- + S°
Ионы свинца и ртути, попадающие в организм с пищей или воздухом, образуют плохо растворимые нетоксичные сульфиты:
Рb2+ + SO32- = РbSO3
Цианид-ионы взаимодействуют с элементной серой, образуя менее ядовитые тиоцианаты:
СN- + S° = NСS-
Применяют натрий тиосульфат и для лечения чесотки. После втирания в кожу раствора делают повторные втирания 6%-ного раствора НСl. В результате реакции с НСl натрий тиосульфат распадается на серу и диоксид серы:
Nа2S2О3 + 2НСl = 2NaСl + SО2 + S + Н2О
которые и оказывают губительное действие на чесоточных клещей.
Оксид серы (VI) SО3 — летучая жидкость. При взаимодействии с водой SО3 образует серную кислоту:
SО3 + Н2О = Н2SО4
Структура молекул серной кислоты соответствует сере в sр3- гибридном состоянии.
Серная кислота — сильная двухосновная кислота. По первой ступени она ионизирована практически полностью:
Н2SО4 ⇄ Н+ + НSО4-,
Ионизация по второй ступени протекает в меньшей степени:
НSО4- ⇄ Н+ + SО42-,
Концентрированная серная кислота — сильный окислитель. Она окисляет металлы и неметаллы. Обычно продуктом ее восстановления является SО2, хотя в зависимости от условий проведения реакции (активности металла, температуры, концентрации кислоты) могут получаться и другие продукты (S, Н2S).
Будучи двухосновной кислотой, Н2SО4 образует два типа солей: средние — сульфаты (Na2SO4 и др.) и кислые — гидросульфаты (NаНSО4, КНSО4 и др.). Большинство сульфатов хорошо растворимы в воде Многие сульфаты выделяются из растворов в виде кристаллогидратов: FеSО4∙7Н2О, СuSО4∙5Н2О. К практически нерастворимым относятся сульфаты ВаSО4, SrSО4 и РbSО4. Малорастворим кальций сульфат СаSО4. Барий сульфат нерастворим не только в воде, но и в разбавленных кислотах.
В медицинской практике сульфаты многих металлов применяют в качестве лекарственных средств Na2SO4∙10Н2О — как слабительное, MgSО4∙7Н2О — при гипертонии, как слабительное и как желчегонное средство, медный купорос СuSО4∙5Н2О и ZnSО4∙7Н2О — как антисептические, вяжущие, рвотные средства, барий сульфат ВаSО4 — как контрастное вещество при рентгенологическом исследовании пищевода и желудка
Соединения селена и теллура. По химическим свойствам теллур и в особенности селен похожи на серу. Однако усиление металлических свойств у Sе и Те повышает их склонность к образованию более прочных ионных связей. Сходство физико-химических характеристик: радиусов ионов Э2-, координационных чисел (3, 4) — обусловливает взаимозамещаемость селена и серы в соединениях. Так, селен может замещать серу в активных центрах ферментов. Замена водородсульфидной группы —SН на водородселенидную группу —SеН изменяет течение биохимических процессов в организме. Селен может выступать как синергистом, так и антагонистом серы.
С водородом Sе и Те образуют аналогичные Н2S очень ядовитые газы Н2Sе и Н2Те. Диводородселенид и диводородтеллурид являются сильными восстановителями. В ряду Н2S—Н2Sе—Н2Те восстановительная активность растет.
Для Н2Sе выделены как средние соли — селениды (Nа2Sе и др.), так и кислые соли — гидроселениды (NaНSе и др.). Для Н2Те известны только средние соли — теллуриды.
Соединения Sе (IV) и Те (IV) с кислородом в отличие от SО2 — твердые кристаллические вещества SеО2 и ТеО2.
Селенистая кислота Н2SеО3 и ее соли селениты, например Nа2SеО3, — окислители средней силы. Так, в водных растворах они восстанавливаются до селена такими восстановителями, как SО2, Н2S, НI и др.:
Н2SеО3 + 2SО2 + Н2О = Sе + 2Н2SО4
Очевидно, что легкость восстановления селенитов до элементного состояния обусловливает образование в организме биологически активных селенсодержащих соединений, например селеноцистеина.
SеО3 и ТеО3 — кислотные оксиды. Кислородные кислоты Sе (VI) и Те (VI) — селеновая Н2SеО4 и теллуровая Н6ТеО6 — кристаллические вещества с сильными окислительными свойствами. Соли этих кислот называются соответственно селенатами и теллуратами.
В живых организмах селенаты и сульфаты — антагонисты. Так, введение сульфатов приводит к выведению из организма избыточных селенсодержащих соединений.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1040; Нарушение авторских прав?; Мы поможем в написании вашей работы!