
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Визначення молекулярної маси білків
|
|
|
|
Молекулярна маса білків велика, і для їх визначення часто доводиться використовувати зовсім інші методи, ніж в органічній хімії.
Осмотичний тиск. Якщо речовина, розчинена у воді, відокремлена від чистої води мембраною, проникною для води і непроникною для цієї речовини, то вода поступатиме всередину об'єму, обмеженого мембраною, в якому знаходиться розчин. Причина цього лежить в необхідності компенсувати більш низьку концентрацію води усередині об'єму. В результаті цього рівноважному стану відповідатиме більш високий рівень рідини усередині об'єму в порівнянні з рівнем води, що знаходиться зовні. Обумовлений ним надмірний тиск рівний осмотичному тиску. Величина тиску визначається співвідношенням:

де p – осмотичний тиск в атмосферах; R – універсальна газова постійна; С – мольна концентрація розчиненої речовини; T – абсолютна температура.
Величину С можна замінити на 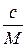 , де с – концентрація в грамах на літр, а M – молекулярна маса.
, де с – концентрація в грамах на літр, а M – молекулярна маса.
Тоді:
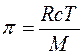 , звідки:
, звідки: 
Схематичний дослід ставиться таким чином. Розчин білка в буфері заливають у мішечок, виготовлений з непроникної для білків мембрани і забезпечений трубкою, по якій може підійматися рідина. Ця трубка одночасно служить і манометром. Все це занурюють в посудину, куди налитий чистий буфер. Після досягнення рівноваги вимірюють висоту рідини в трубці і по ній обчислюють p. Цей метод придатний для не дуже великих білків, в протилежному випадку підйом рідини буде нікчемно малий. Важливо також, щоб в розчині знаходився білок тільки одного типу, інакше буде отримана цифра середньої молекулярної маси.
Аналітичне центрифугування. Центрифугування можна використовувати для фракціонування субклітинних частинок. З його допомогою можна також і осаджувати білки. Відцентрова сила прагне осадити білки на дно центрифужної пробірки, але завдяки дифузії молекули білка мають тенденцію мігрувати із зони високої концентрації в області більшого розбавлення. Застосовують два способи дослідження.
|
|
|
а) при відносно малій швидкості обертання після закінчення достатньо тривалого періоду часу відцентрова сила і дифузія приходять в рівновагу. Рівновага седиментації дозволяє визначити молекулярну масу білка при умові, якщо відомі параметри, які відносяться до його дифузійної здатності. Незручність цього методу в його тривалості. Арчібальд запропонував модифікацію, що дозволяє скоротити тривалість центрифугування до 1 – 2 годин.
б) при великій швидкості обертання відцентрова сила така велика, що сили дифузії виявляються в порівнянні з нею дуже малими. В цих умовах можна визначити швидкість седиментації білка. Утворюються величини в діапазоні від 1 до 200 одиниць Сведберга.
Дія відцентрової сили залежить не тільки від молекулярної маси білка, але також від форми його молекули і від зв'язків між білком і молекулами оточуючої його води.
Вимірювання такого роду проводять в аналітичних ультрацентрифугах, які служать стандартними приладами в цій області. Цей оптичний пристрій дозволяє стежити за переміщенням білка по пробірці в ході центрифугування. Осадження білка спостерігають як гауссову криву, що переміщується уздовж осі. Площа, між цією кривою і віссю абсцис, пропорційна концентрації білка. Гауссова крива утворюється в результаті відхилення світлового променя. Проходячи через розчин, промінь зустрічає на своєму шляху білок, коефіцієнт заломлення якого вище, ніж у розчинника.
Через певні проміжки час проводиться фотографування і таким чином обчислюється швидкість переміщення кривої, а отже, і швидкість седиментації білка. Результати цих вимірювань служать відправною точкою для визначення молекулярної маси.
|
|
|
Світлорозсіювання. Якщо освітлювати розчин солі дуже тонким пучком світла, то він проходить крізь розчин по прямій лінії. Якщо виконати те ж саме з розчином білка, то можна побачити, що частина світла розсіюється у всіх напрямках. Це явище обумовлено тим, що розміри білкових молекул співвимірні з довжиною хвилі світла і поводять себе як маленькі дзеркала, повернені у всі сторони, куди вони і розсіюють падаюче світло. Можна виміряти інтенсивність світла, яке розсіюється під різними кутами по відношенню до падаючого променя. Відношення інтенсивності світла, яке розсіяне під певним кутом (i), до інтенсивності падаючого світла (I) пропорційно концентрації білка (с) і його молекулярній масі (M), тобто:

де К – константа, залежна від конструкції приладу.
Гель-фільтрація. Ми вже говорили про те, що хроматографія на декстрані дозволяє розділяти речовини за їх молекулярними масами. Хроматографічну колонку калібрують, використовуючи для цього ряд білків з відомою молекулярною масою, потім визначають молекулярну масу досліджуваного білка, шляхом зіставлення і екстраполяції. У такий спосіб знаходять приблизне значення молекулярної маси. Метод чутливий не тільки до молекулярної маси, але і до форми білкової молекули. Для білків однакової конфігурації об'єм рідини, яка елюює білок з колонки, обернено пропорційний логарифму його молекулярної маси.
Хімічні методи. Фізичні методи завжди дають наближені результати. Їх можна доповнити даними, отриманими за допомогою хімічних методів, які самі по собі також недостатні.
Наприклад, хочуть визначити молекулярну масу гемоглобіну. Аналіз показує, що цей білок містить 0,34% заліза. Якщо вважати, що на кожну молекулу гемоглобіну доводиться один атом заліза, то, виходячи з атомної маси заліза 56, можна знайти молекулярну масу білка із співвідношення:
 ,
, 
Фізичні методи дають для гемоглобіну величину молекулярної маси близько 65 000. Звідси можна визначити, що точна молекулярна маса гемоглобіну рівна 17000 ´ 4 = 68000 і, що кожна його молекула містить чотири атоми заліза.
Електронна мікроскопія. В даний час електронна мікроскопія дає збільшення в 20 Å, що дозволяє бачити білки. Підраховувавши число білкових глобул, можна отримати приблизну величину молекулярної маси. Для цього достатньо знати концентрацію білка в розчині і об'єм, який спостерігається в мікроскоп. Для того, щоб визначити цей об'єм, до розчину додають відоме число частинок латексу, які теж можна бачити в полі мікроскопа і порахувати.
|
|
|
Визначення молекулярної маси білкових субодиниць. В основному використовують два методи.
Електрофорез в поліакриламідному гелі з додецилсульфатом натрію (ДСН). Ми вже говорили, що при електрофорезі в поліакриламідному гелі швидкість пересування молекул білка залежить від їх заряду, форми і молекулярної маси. Якщо білок обробити денатуруючим детергентом ДСН, то, з одного боку, він денатурує і втрачає свою специфічну форму, а з іншою – розпадається на субодиниці, які приєднують ДСН і набувають однакового негативного заряду. Якщо ці субодиниці піддати електрофорезу в поліакриламідному гелі, то швидкість їх переміщення залежатиме тільки від молекулярної маси, причому вона виявляється обернено пропорційною логарифму молекулярної маси. Якщо білок складався з декількох субодиниць різної молекулярної маси, то виявиться декілька смуг.
Гель-фільтрація у присутності сечовини. Молекулярну масу субодиниць можна визначати і хроматографією на декстрані, якщо до проведення хроматографії додати до білка агент, який руйнує водневі зв'язки, наприклад сечовину високої концентрації.
Фракціонування білків.
Дуже часто задачею біохімічного дослідження є вивчення білків тканин або біологічної рідини. Рішення такої задачі доводиться починати з відділення різних білків один від одного, тобто, з їх фракціонування. У ряді випадків необхідно отримати досліджуваний білок в чистому вигляді і перевірити ступінь його чистоти за допомогою спеціальних критеріїв. Якщо вихідним матеріалом служать клітини тканин, то першим етапом роботи є розтирання або гомогенізація, за якою слідує діаліз, що видаляє присутні в середовищі малі молекули. Після цього послідовно використовують різні методи фракціонування.
|
|
|
Висолювання. Високі концентрації сульфату амонія і фосфатів лужних металів осаджують білки. Поступово збільшуючи концентрацію солі, можна послідовно висолити всі розчинні білки. Прийом використовують як перший ступінь фракціонування. Його ефективність невисока – майже завжди в результаті одержують ще суміш білків.
Ізоелектричне осадження. Варіюють рН середовища. Поблизу ізоелектричної точки білки мають тенденцію до випадання в осад. Таким шляхом вдається розділяти білки, які дуже відрізняються один від одного за ізоелектричною точкою.
Адсорбційна хроматографія. Деякі тверді речовини у вигляді порошків або гелів володіють здатністю зв'язувати білки слабими і малоспецифічними зв'язками. До їх числа відносяться оксид алюмінію, фосфат кальцію (гідроксил-апатит), силікагель, крохмаль.
Десорбцію білків можна проводити з використанням найрізноманітніших елюентів. Якщо елюція є виборчою, то за допомогою колектора фракцій можна збирати білки роздільно один від одного, а іноді в очищеному вигляді.
Хроматографія на іонообмінних смолах. Це один з найефективніших методів. Смоли, які зазвичай використовують для фракціонування амінокислот, тут непридатні, оскільки полімери, з яких виготовлені смоли, мають дуже часту сітку і білки не можуть проникати через її осередки. Проблема була вирішена шляхом закріплення іонізованих груп на твердому носії – целюлозі. Таким чином отримали хроматографічний метод, в якому одночасно має місце як адсорбція, так і іонний обмін. Як аніонообмінник використовують діетиламіноетилцелюлозу (ДЕАЕ-целюлозу), а як катіонообмінник – карбоксиметилцелюлозу (Км-целюлоза).
Розчинені в буфері білки подають на колонку, а потім елююють буфером у якому постійно змінюється рН (зростає або убуває). При цьому білки розділяються відповідно до їх зарядів і значення pHi. Їх збирають за допомогою колектора фракцій.
Хроматографія на декстрані (гель-фільтрація) дозволяє фракціонувати білки за молекулярною масою.
Афінна хроматографія (хроматографія за спорідненістю). Якщо білок здатний специфічно утворювати комплекси з певною речовиною, то цю речовину „пришивають” ковалентними зв'язками до інертного порошку носія і заповнюють ним хроматографічну колонку. Коли через таку колонку пропускають білкову суміш, то на ній затримується тільки здатний до утворення комплексу білок, який потім можна зняти відповідним елюентом. Таким шляхом вдається виділити певний білок з складної суміші.
Кристалізація. Іноді з її допомогою вдається отримати білок в чистому вигляді. Цим методом готують високо очищені ферментативні білки. Дуже часто кристалізацію ведуть з концентрованих сольових розчинів.
Аналіз і критерії чистоти білків. Описані нижче методи дозволяють, з одного боку, ідентифікувати різні білки, які входять до складу біологічного препарату (аналіз). З другого боку, з їх допомогою вдається показати, що в результаті виділення був отриманий дійсно індивідуальний білок (критерій чистоти). Це часто більш тонкі методи, ніж ті, які використовуються для фракціонування, і вимагають значно менших кількостей білка.
Фізичні методи. Зональний електрофорез. Методом електрофореза на ацетаті целюлози або в поліакриламідному гелі вдається розділяти дуже схожі між собою білки. Якщо білок, що вноситься, чистий, то електрофорез дає одиночну тонку смужку.
Електрофокусування. Проводять зональний електрофорез, але при цьому використовують спеціальну суміш буферів, яка забезпечує плавну зміну рН уздовж всієї довжини гелю. В кінці електрофореза кожний білок опиняється в тій зоні гелю, де рН буфера співпадає із значенням ізоелектричної точки білка рНi.
Аналітичне центрифугування. Чистий білок повинен давати при ультрацентрифугуванні один симетричний пік.
Колоночна хроматографія. Індивідуальний білок у різних хроматографічних системах повинен виходити з колонки одним симетричним піком.
Імунологічні методи. Імунологічні методи дозволяють проводити аналіз білкової суміші, дають можливість довести ідентичність двох білків різного походження або перевірити чистоту білка. Найбільш широко використовують два підходи.
Метод подвійної дифузії (Уден-Оухтерлоні). Беруть чашку Петрі і заповнюють її агаровим гелем. Вирізують в гелі два круглі отвори і заповнюють один з них досліджуваним препаратом, а інший – сироваткою тварини, імунізованої цим препаратом. Білок, що міститься в досліджуваному препараті (антиген), одночасно з антитілом дифундують в агарі. В тому місці, де вони зустрічаються, утворюється білий осад. Якщо досліджуваний препарат містить не один, а два білки, то мабуть, що вони будуть дифундувати з різною швидкістю. В цьому випадку утворюються дві роздільні смужки осадів. Таким чином можна встановити, скільки білків міститься в препараті. Ця техніка дозволяє вирішувати і важливу задачу ідентифікації білків. Нехай необхідно з'ясувати, чи є у складі складного білкового препарату певний білок А. Готують сироватку, що містить антитіла як проти досліджуваного препарату, так і проти білка А, і заповнюють нею центральний отвір агарової пластинки. Вирізують ще два отвори – в один з них поміщають комплексний антиген, а в інший – білок А. Між отвором, що містить антитіла, і отвором комплексного антигена утворюється декілька смуг. Між отворами антитіл і білка А, природно, утворюється лише одна смуга. Якщо ця остання смуга зливається своїм кінцем з однією із смуг попереднього набору так, що як би служить її продовженням, то можна стверджувати, що білок А входить до складу суміші. Якщо ж лінії не з'єднуються або перетинають одна одну, то це вказує на відсутність білка А в суміші. Таким чином, цей метод може бути використаний як критерій чистоти білка, так і ідентичності двох білків.
Імуноелектрофорез (Грабар і Вільямс). Якщо антиген є складною сумішшю білків, наприклад сироватки крові людини, то число білків, а отже, і число смуг преципітації стає настільки великим, що картина на агаровій пластинці стає нерозбірливою. Тому необхідно заздалегідь за допомогою електрофореза розфракціонувати білки на склі від мікроскопа, який покритий шаром агару, пропускаючи через нього електричний струм. Під дією струму білки, захоплюються буфером і розподіляються по довжині скла по обидві сторони від центрально розташованого отвору. Антитіла вносять в подовжню канавку. Феномен подвійної дифузії виявляється, як і в попередньому методі, даючи серію дуг, кожна з яких відповідає одному з білків, які радіально дифундують від того місця, куди він був перенесений дією струму. Цей метод чудовий не тільки для аналізу, але і як критерій чистоти препарату.
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1016; Нарушение авторских прав?; Мы поможем в написании вашей работы!