
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
От дисперсности
Зависимость термодинамической реакционной способности
В термодинамике реакционная способность определяется энергией Гиббса. Равновесие в системе сожжет сдвигаться, т.е. изменяться реакционная способность, при изменении дисперсности вещества. Приращение энергии Гиббса при изменении дисперсности можно записать:
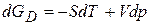 (3.29)
(3.29)
Для индивидуального вещества 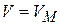 (мольный объем) при Т -
(мольный объем) при Т - 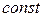 имеем (для одного моль вещества):
имеем (для одного моль вещества):
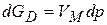 или
или 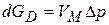 (3.30)
(3.30)
По уравнению Лапласа:
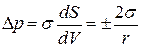 , тогда
, тогда
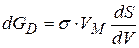 или
или 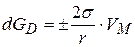 (3.31)
(3.31)
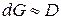
Из этих уравнений видно, что приращение реакционной способности за счет изменения дисперсности пропорционально кривизне поверхности или дисперсности. (+) и (-) - положительная или отрицательная величина.
Если рассматривается переход из конденсированной фазы в газообразную, то энергия Гиббса выражается через давление пара, в этом случае:
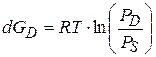 (3.32)
(3.32)
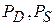 - давление насыщенного пара над искривленной и плоской поверхностью (большой радиус кривизны)
- давление насыщенного пара над искривленной и плоской поверхностью (большой радиус кривизны)
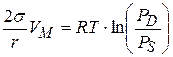
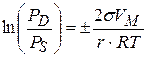 - уравнение Кельвина (Томсона)
- уравнение Кельвина (Томсона)
При анализе уравнения Кельвина видно:
1. При положительной кривизне давление насыщенного пара над искривленной поверхностью (над каплей) будет тем больше, чем больше кривизна или меньше радиус.
2. При отрицательной кривизне, при смачивании, давление насыщенного пара уменьшается с увеличением кривизны и уменьшением радиуса.
Таким образом, если жидкость смачивает капилляр, то конденсация в капилляре по сравнению с ровной поверхностью происходит при меньшем давлении, поэтому уравнение Кельвина называют уравнением капиллярной конденсации.
Из уравнения Кельвина видно, что влияние дисперсности на давление насыщенного пара тем больше, чем больше 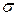 и
и 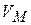 .
.
С увеличением дисперсности растет растворимость веществ. Для неэлектролитов уравнение Гиббса можно записать:
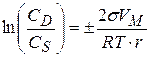 (3.34)
(3.34)
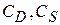 - растворимости вещества в высокодисперсном состоянии при равновесии с крупными частицами вещества.
- растворимости вещества в высокодисперсном состоянии при равновесии с крупными частицами вещества.
Для электролитов (пренебрегая коэффициентом активности):
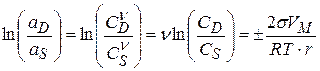 (3.35)
(3.35)
где 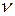 - число ионов, на которые диссоциирует электролит.
- число ионов, на которые диссоциирует электролит.
Влияние дисперсности на растворимость зависит от знака кривизны. Если частицы твердого вещества имеют неправильную форму, то участки с положительной кривизной будут растворяться, а с отрицательной наращиваться до равновесного состояния.
Степень дисперсности влияет и на равновесие химической реакции:
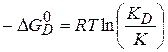 (3.36)
(3.36)
где 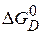 - приращение химического сродства, обусловленное дисперсностью,
- приращение химического сродства, обусловленное дисперсностью,
 - константа, учитывающая влияние дисперсности,
- константа, учитывающая влияние дисперсности,
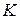 - константа недеспергированного вещества.
- константа недеспергированного вещества.
С увеличением дисперсности растет активность компонентов и изменяется константа равновесия в ту или другую сторону в зависимости от степени дисперсности исходных веществ и продуктов реакции.
Например:
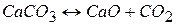
С увеличением дисперсности 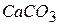 равновесие сдвигается вправо и давление
равновесие сдвигается вправо и давление 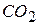 в системе возрастает. Увеличение дисперсности
в системе возрастает. Увеличение дисперсности 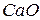 приводит к сдвигу равновесия влево.
приводит к сдвигу равновесия влево.
|
Дата добавления: 2014-01-11; Просмотров: 3284; Нарушение авторских прав?; Мы поможем в написании вашей работы!