
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Контрольні питання до теми 3.5
|
|
|
|
Потенціометрія, теоретичні основи методу. Електроди індикаторні та зрівняння. Потенціометричне визначення рН, скляний електрод. Іон селективні електроди, класифікація, практичне використання. Пряма потенціометрія та потенціометричне титрування. Індикаторні електроди в реакціях, кислотно-основних, осадження, окиснення-відновлення. Криві титрування, способи визначення кінцевої точки титрування. Вимірювання потенціалу. Прилади.
Потенціометричний аналіз
Електрохімічні методи аналізу засновані на вимірюванні параметрів електрохімічних явищ, які виникають у досліджуваному розчині.
Розрізняють дві групи електрохімічних методів:
1.Без накладення потенціалу – потенціометричний метод;
2.З накладенням на електрохімічну комірку потенціалу: кондуктометрія; кулонометрія; вольтамперметрія.
Потенціометрія заснована на вимірюванні різниці електричних потенціалів, виникаючої між різнорідними електродами, які розташовані у розчині з речовинами, які визначаються.
Для виконання потенціометричних вимірювань збирають електрохімічну комірку з індикаторного електроду та електроду порівняння. Потенціал індикаторного електроду залежить від концентрації (активності) іонів, які визначаються. Потенціал електроду порівняння сталий, не залежить від складу розчину і має заздалегідь відому величину (цей електрод ще зветься допоміжним).
Індикаторними електродами, які частіше за усе використовуються у потенціометрії, є металеві і мембрані електроди.
Металеві електроди підрозділяються на активні та інертні. Активні металеві електроди виробляються з металів Ag, Cu, Pb, які утворюють відновну форму зворотної окисне-відновної пів реакції. Кожен з таких електродів у розчині, який містить іони цього ж металу, набуває рівноважного потенціалу, який зворотно змінюється при змінюванні активності цих іонів і відбивається рівнянням Нернсту:
|
|
|
 ,
,
де Е - потенціал електроду В,
Е0 - стандартний потенціал, В,
n - кількість електронів, які приймають участь у реакції:
Men+ + ne- 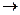 Me
Me
Інертні металеві електроди(рис. 3.16 а) виробляються з платини чи золоту і використовуються для виміру потенціалу розчину, який містить окисно-відновну пару(наприклад Fe3+/Fe2+). Вони індиферентні - не приймають безпосередньої участі у реакції, а використовуються лише для переносу електронів. Їх потенціал залежить тільки від співвідношення активності окислювальної і відновної форм:
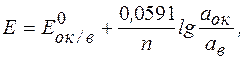
Де: аок, ав - активності окислювальної і відновної форм іонів відповідно, моль/л.
Мембранні електроди, які ще звуться іон селективними, мають мембрану, проникливу переважно для іонів одного сорту у присутності інших іонів однакового знаку заряду.
В залежності від матеріалу, який використовується при їх приготуванні, розрізняють скляні електроди, а також електроди з твердими (гетерогенними) та рідкими (гомогенними) мембранами.
Першим електродом зі скляною мембраною був електрод, селективний відносно H+ - іонів, котрий витиснув з використання усі інші електроди, зворотні відносно іонів водню (водневий, сурм’яний, хінгідроний). Пізніше були створені скляні електроди для визначення іонів K+, Na+.
а-індифирентний платиновий електрод; 1-платинова нить, 2- дріт, 3-корпус, 4- ущільнення, 5-контактний провід.
б-скляний електрод; 1-мембрана з електродного скла, 2-допоміжний електрод, 3-приелектродна рідина, 4-корпус, 5-ущільнення, 6-провід.
в-іон селективний електрод з твердою мембраною; 1-тверда мембрана, 2-допоміжний електрод, 3-приелектродна рідина, 4-корпус, 5-ущільнення, 6-провід.
г-хлорид срібний електрод порівняння; 1-азбестова нить, 2-насичений розчин КСІ, 3-скляна трубка, 4-корпус, 5,8-гумові корки, 6-порожнина, 7-срібний дріт, 9-ущільнення, 10-провід.
|
|
|
Рис. 3.16 - Електроди для потенціометричних вимірювань
Робота скляного електроду заснована на реакції іонного обміну, а не на процесі переносу електронів, Це скляна трубка 4(рис. 3.16 б) на кінці якої розташована мембрана з електродного скла 1, яка заповнена 0,1М розчином НСІ. В цей розчин занурене допоміжний електрод у вигляді срібного дроту, вкритого хлоридом срібла. Залежність потенціалу електроду від рН підпорядковується рівнянню:
Еел.=Е1 -0,059 рН.
Для електродної системи, яка складена зі скляного вимірювального електроду і хлорид срібного електроду порівняння ЕРС електродної системи:
Е=Еі – (54,197 + 0,1984t)(pH-pHi),
де: Еі і рНі - координати ізопотенціальної точки(рис. 3.17).
Електрорушійна сила (ЕРС) системи, складеної з індикаторного електроду і електроду порівняння, залежить не тільки від активності іонів, але, також, і від температури(рисунок 3.17). Поправка на температуру у сучасних приборах запроваджується автоматично чи у ручну.
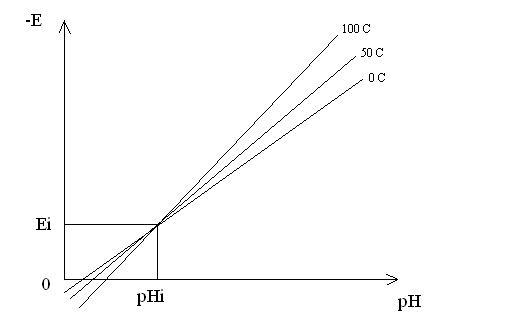
Еі, рНі – координати ізопотенціальної точки.
Рисунок 3.17 – Залежність потенціалу індикаторного електроду від рН при різних температурах
Іон селективні електроди використовуються для визначення катіонів і аніонів. Виготовляються скляні мембранні електроди специфічні відносно іонів K+, Na+, Ag+, NH4+. Відомі електроди з твердими іонітовими іон селективними мембранами(рис. 3.16 в) для визначення Cl-, Br-, I-, SCN-. Сьогодні промисловість виготовляє іон селективні електроди для визначення понад 40 іонів.
Електродами порівняння у потенціометрії використовують каломельні та хлорид срібні електроди. Останні використовуються частіш за усе. Потенціал хлорид срібного електроду постійний і дорівнює +0,201В відповідно до стандартного водневого електроду. Хлорид срібний електрод порівняння(рисунок 3.16 г) складається з металічного срібла, вкритого хлоридом срібла і розташованого у насиченому розчині КСl. На електроді відбувається оборотна реакція:
AgClтв + e- 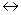 Agтв + Cl-
Agтв + Cl-
Потенціал електроду залежить від активності іонів хлору, які знаходяться у рівновазі з твердим хлоридом срібла, і у насиченому розчині їх активність стала.
|
|
|
Розрізняють у потенціометрії пряму потенціометрію і потенціометричне титрування.
Пряма потенціометрія (іонометрія) передбачає вимірювання потенціалу відповідного іон селективного електроду, зануреного в розчин, що аналізується. За визначеним значенням потенціалу розраховують активність іону за рівнянням Нернсту. Оскільки визначити потенціал електроду неможливо, вимірюють ЕРС-Е гальванічного елементу, складеного з індикаторного та електроду порівняння, яка зв'язана з потенціалами електродів:
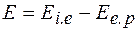
де: Eі.е - потенціал індикаторного
Ее.р. - потенціал електроду порівняння (допоміжного).
За значенням ЕРС визначають потенціал індикаторного електроду. Прилади для вимірювання рН звуться рН-метрами, їх шкала градуйована в одиницях рН і мВ. Налаштування електродної системи здійснюється за буферними розчинами.
Для роботи з іон селективними електродами виготовляються прилади іономіри, шкала яких градуйована в одиницях рХ і мВ.
Потенціометричне титрування засновано на визначені точки еквівалентності по зміненню потенціалу індикаторного електроду при титруванні, який змінюється із зміненням активності визначаємих іонів у розчині внаслідок їх взаємодії з титрантом.
Потенціометричне титрування здійснюється на приладі, який складається з бюретки 3, потенціометричної комірки 1 з електродною системою, магнітної мішалки 6 іономіра (pH-метру) 4 (рисунок 3.18).
Якщо використати автоматичну подачу титранту (блок 2) і автоматичний двох координатний реєстратор (блок 5), то можливо отримати зображення кривої титрування в інтегральній формі.
Кінцева точка титрування також може бути визначена за допомогою блоків автоматичного титрування до визначеного заздалегідь pH чи окислювальне-відновного потенціалу розчину.
При титруванні вимірюють і реєструють ЕРС гальванічного елементу після додання кожної порції титранту. З початку титрування титрант додають в об'ємі 0,5-1 мл, а біля кінцевої точки титрування, де має місце стрибок аналітичного сигналу, кількість титранту зменшують до 0,1¸0,2 мл. Кінцеву точку титрування визначають графічно за інтегральними чи диференційними кривими (рисунок 3.19).
|
|
|
В потенціометричному титруванні використовують кислотно-лужні, окислювальне-відновні реакції, а також реакції осаду та комплексоутворюючі, які здійснюються швидко, кількісно та стехіометрично.
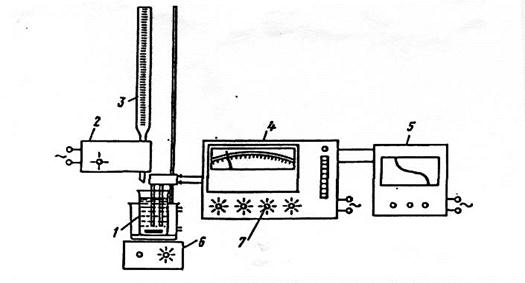
1-потенціометрична комірка; 2-блок автоматичного титрування; 3-бюретка; 4-рН-метр; 5-реєстратор; 6-мішалка; 7-ручки управління.
Рисунок 3.18 - Схема приладу для потенціометричного титрування
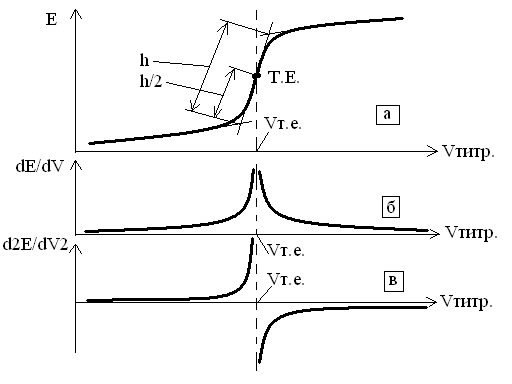
а – інтегральна, б,в – диференційні.
Рисунок 3.19 - Криві потенціометричного титрування
В кислотне-лужному титруванні реакція пов'язана з змінюванням аH+ чи pH розчину. Тому використовуються скляні електроди.
В окислювальне-відновних реакціях використовують індиферентні платинові чи золоті електроди.
В реакціях осаду та комплексоутворення не існує універсального індикаторного електроду, тому використовують різноманітні іон селективні електроди.
Метод потенціометричного титрування дозволяє здійснити визначення у забарвлених середовищах. Він дає більшу точність в зрівнянні з прямою потенціометрією, оскільки біля точки еквівалентності невеликому зміненню об'єму титранту відповідає велике змінення потенціалу індикаторного електроду.
На інтегральній кривій (рисунок 3.19 а) кінцевій точці титрування відповідає точка перегину. Для її знаходження будують дотичну до нижньої і верхньої частин кривої і в середині стрибка титрування визначають точку еквівалентності і об'єм Vт.е. титранту, який був необхідний для взаємодії з визначаємою речовиною.
Ретельніше можливо визначити Vт.э побудувавши диференційні криві у координатах  DE/DV-V чи D2E/DV2-V(рисунок 3.19 б,в). Вміст аналізуємої речовини визначається за формулами титрометричного аналізу.
DE/DV-V чи D2E/DV2-V(рисунок 3.19 б,в). Вміст аналізуємої речовини визначається за формулами титрометричного аналізу.
Визначення електрорушійної сили гальванічного елементу, складеного з індикаторного та допоміжного електродів, може бути здійснено з достатньою точністю, або компенсаційним методом або за допомогою високоомних перетворювачів. Це пов'язано з тим, що через розчин не повинен текти електричний струм, щоб не змінювалася концентрація аналізуємої речовини внаслідок електролізу.
Частіш за усе у лабораторіях використовують pH-метри pH-121, pH-125, pH-340, іонометри ЭВ-77, И-102 та інші. Іонометри, на відміну від pH-метрів, можуть робити не тільки з H+- селективними електродами, але, також, і з електродами, селективними відносно інших катіонів та аніонів.
Як ті, так і інші прилади принаймні використовуються і для виміру напруги і мають шкалу, градуйовану в мілівольтах.
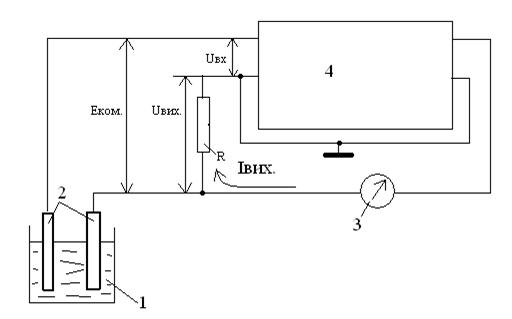
1-комірка; 2-електроди; 3-мікроамперметр; 4-підсилювач
Рисунок 3.20 – Компенсаційна схема вимірювання потенціалу
Робота іонометру заснована на перетворені ЕРС електродної системи в постійний струм, пропорційний вимірюваній напрузі. Перетворення здійснюється високоомним перетворювачем авто компенсаційного типу (рисунок 3.20).
ЕРС електродної системи Еком. порівнюється зі спадом напруги на резисторі R, через котрий тече струм Івих. Спад напруги Uвих протилежне за знаком Eком. і на вхід підсилювача діє напруга:
Uвх = Еком. - Uвих=Еком. - Івих×R
При досить великому коефіцієнті підсилення струм через розчин вельми малий, напруга Uвих майже не відрізняється від Eком. і, завдяки цьому, струм Івих пропорцієн ЕРС електродної системи і pX(pH) контролюємого розчину.
1.На чому засновано потенціометричний метод аналізу?
2.Яка сутність роботи активних металевих індикаторних електродів?
3.Яка сутність роботи металевих індиферентних електродів? Від чого залежить потенціал таких електродів?
4.На чому засновано метод прямої потенціометрії?
5.На чому засновано метод потенціометричного титрування?
6.Які електроди використовуються як індикаторні при потенціометричному кислотно-лужному титруванні?
7.Які електроди використовуються як індикаторні при потенціометричному окисно-відновному титруванні?
8.Які електроди використовуються як індикаторні при потенціометричному титруванні в реакціях осаду і комплексоутворювання?
9.Як визначається точка еквівалентності при потенціометричному титруванні?
10.Наведить схему і поясність сутність роботи високоомного перетворювача іономіру.
Тема 3.6 Кондуктометрія(2 год)
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1542; Нарушение авторских прав?; Мы поможем в написании вашей работы!