
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кондуктометричне титрування. Криві титрування
|
|
|
|
Теоретичні основи методу. Вимірювання електропровідності розчинів. Електролітичні комірки. Низько- і високочастотна кондуктометрія. Вимірювальні схеми кондуктометрів. Пряма кондуктометрія. Використання методу. Кондуктометричне титрування. Криві титрування.
Згідно номенклатурі, яку ввів Фарадей, відрізняють два типу провідників струму: першого і другого роду. За сучасними уявленнями у разі провідників першого роду електропровідність забезпечують електрони, а у разі провідників другого роду – іони. До провідників першого роду відносять метали і сплави, графіт, деякі тугоплавкі оксиди. До провідників другого роду відносять електроліти – речовини, які в розплавленому чи розчиненому стані спроможні розпадатися на іони.
Провідність провідників характеризується електропровідністю – L, яка оборотна опору:
L =  .
.
Опір провіднику R прямо пропорційний його довжині l і зворотно пропорційний перетику S:
R =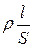 ,
,
де: 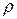 - питомий опір, характеризує опір провіднику з одиничними розмірами: довжиною і перетиком, які дорівнюють одиниці. Величина, яка зворотна питомому опору:
- питомий опір, характеризує опір провіднику з одиничними розмірами: довжиною і перетиком, які дорівнюють одиниці. Величина, яка зворотна питомому опору:
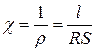 ,
,
зветься питомою електропровідністю  (каппа). Вона має основну одиницю виміру См/м, і може визначатися у См/см (См – сименс = ом-1).
(каппа). Вона має основну одиницю виміру См/м, і може визначатися у См/см (См – сименс = ом-1).
В зв’язку з тим, що електропровідність електроліту обумовлена пересуванням іонів у розчині, величина питомої електропровідності визначається спроможністю іонів до пересування, концентрацією іонів у розчині і температурою.
Для бінарного одно-одновалентного електроліту при постійній температурі залежність питомої електропровідності від швидкості пересування іонів і їх концентрації у розчині для сильних електролітів визначається рівнянням:
|
|
|
 = Ci
= Ci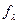 F(Uk + Ua),
F(Uk + Ua),
де: F - число Фарадея;
Ci - концентрація розчину, моль-екв./л;
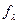 - коефіцієнт електропровідності
- коефіцієнт електропровідності
Uk, Ua - швидкість пересування іонів при градієнті потенціалу 1 В/м.
Попереднє рівняння частіше записують у вигляді:
 =
=  Ci
Ci 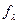 (
( +
+  ),
),
де:  = Uk F і
= Uk F і 
 = Uа F величини, які звуться електропровідностями катіону і аніону. Для слабких електролітів рівняння (5) має вигляд:
= Uа F величини, які звуться електропровідностями катіону і аніону. Для слабких електролітів рівняння (5) має вигляд:
 =
=  Ci
Ci 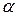 (
( +
+  ),
),
де: 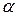 - ступінь дисоціації.
- ступінь дисоціації.
Залежність питомої електропровідності від концентрації електроліту у дійсності складніша, ніж можна очікувати за наведеними рівняннями, оскільки із змінюванням концентрації міняється швидкість пересування іонів.
χ, См/см

Рисунок 3.21 - Залежність питомої електропровідності від концентрації
Питома електропровідність для сильних і більшості слабких електролітів залежить від концентрації розчину. При цьому з ростом концентрації питома електропровідність досягає максимуму, а потім зменшується (рисунок 3.21). Така залежність для сильних електролітів обумовлена протилежним впливом на електропровідність ефекту зростання концентрації іонів і ефекту між іонної взаємодії, яка зростає з ростом концентрації розчину. Після максимуму між іонна взаємодія впливає більше, ніж зростання концентрації іонів. Для слабких електролітів ріст концентрації іонів з ростом концентрації електроліту змінюється у точці максимуму зменшенням абсолютної кількості іонів внаслідок суттєвого зменшення ступеню дисоціації.
З ростом температури на один кельвін питома електропровідність зростає приблизно на 2-2,5 %. Це пояснюється зниженням густини розчинів, зменшенням гідратації іонів, а для слабких електролітів збільшенням їх ступеню дисоціації. Залежність питомої електропровідності розбавлених розчинів від температури підкорюється емпіричному рівнянню:
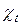 =
=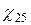 [1+
[1+
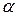 (t – 25) +
(t – 25) + 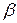 (t - 25)2],
(t - 25)2], 
де: 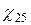 - питома електропровідність при 250С;
- питома електропровідність при 250С;
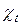 - питома електропровідність при температурі t;
- питома електропровідність при температурі t;
|
|
|
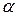 і
і 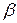 - температурні коефіцієнти електропровідності, де:
- температурні коефіцієнти електропровідності, де:
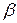 = 0,0163(
= 0,0163(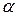 - 0,0174).
- 0,0174).
 Коефіцієнти
Коефіцієнти 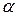 і
і 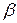 залежать від природи електроліту. Для сильних кислот
залежать від природи електроліту. Для сильних кислот 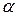 = 0,0164, для сильних основ
= 0,0164, для сильних основ 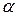 = 0,0190, для солей
= 0,0190, для солей 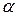 =0,0220.
=0,0220.
Кондуктометричні вимірювання можливо здійснювати на змінному і сталому струмі. Вимірювання на сталому струмі виконують рідко. Це пов’язано з поляризацією електродів і неможливістю точно виміряти електропровідність розчину. Частіше виконують виміри електропровідності за допомогою пристроїв, які працюють на змінному струмі. В цьому випадку спотворення результатів внаслідок поляризації електродів на 2 порядки менше, чим на сталому струмі. Такі пристрої включають в себе електролітичну комірку для вимірювання електропровідності, джерело змінного струму і вимірювальну схему.
Електролітичні комірки можуть бути контактними і безконтактними. Самою простою з них є двохелектродна комірка (рисунок 3.22 а), яка складається із сосуду 1 з двома інертними металічними електродами 2 і 3. Для зменшення зовнішніх електричних наводок на результат вимірювання застосовують 3-х електродні комірки (рисунок 3.22 б), які представляють собою, по суті, дві двохелектродні комірки, які підключені паралельно. Для зменшення впливу явища поляризації електродів на результат вимірювання, застосовують 4-х електродні комірки (рисунок 3.22 в). В цих комірках електроди 2 і 5 виконують функції підвода електричної енергії до комірки а електроди 3 і 4 використовуються для отримання вимірювальної інформації.
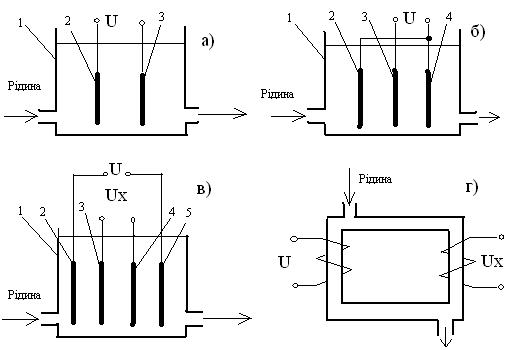
Рисунок 3.22 – Схеми вимірювальних електролітичних комірок
При кондуктометричних визначеннях вимірюють опір розчину R. Якби розчин проводив електричний струм тільки між електродами, то знаючи розстань між електродами - l і їх поверхню – S можна було б визначити питому електропровідність. Однак в електролітичній комірці струм може проводити увесь розчин, тому електролітичну комірку калібрують по розчину з відомою питомою електропровідністю. Для цього питому електропровідність зображають залежністю:
χ = Lекс.,
Lекс.,
де: К – константа(стала) сосуду, яка залежить від поверхні електродів, розстані між ними, а також від форми сосуду і об’єму розчину. Звичайно вимірюють електропровідність 0,001н чи 1н розчину КСl (питома електропровідність їх відповідно дорівнює 0,000127 і 0,09827 См/см при 180С) і розраховують «сталу» сосуду. Для визначення питомої електропровідності виміряну електропровідність треба помножити на сталу «сосуду».
|
|
|
Безконтактні електролітичні комірки (рисунок 3.22 г) можуть бути використані для вимірювання електропровідності і для кондуктометричного титрування рідких середовищ, які містять зважені, колоїдні частки, а також кристалізуючи речовини. Такі комірки можуть робити при коливаннях до 1000 Гц (безконтактна низькочастотна кондуктометрія) і на більш високих частотах 105-108 Гц (високочастотна кондуктометрія).
Як джерела живлення при вимірюванні електропровідності розчинів використовують генератори звуковою частоти та високочастотні генератори.
Вимірювальні схеми лабораторних та промислових кондуктометрів в більшості випадків побудовані за мостовою схемою з ручним (рисунок 3.23 а), або автоматичним (рисунок 3.23 б) урівноваженням.
При ручному урівноваженню (рисунок 3.30 а) переміщенням движку реохорду R3 досягають рівно важності мосту, яке визначається умовою:
R1*Rе.к. = R2*R3.
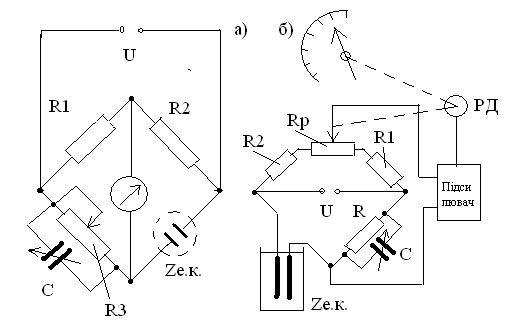
а – з ручним урівноваженням; б- з автоматичним урівноваженням
Рисунок 3.23 – Вимірювальні схеми кондуктометрів
На змінному струмі досягнути повного урівноваження не можливо внаслідок присутності в електролітичній комірці крім активної складової Rе.к також реактивної складової RC,L:
Zе.к. = Rе.к+ RC,L.
Для часткової компенсації ємнісної складової паралельно резистору R3 підключають ємність С, яка регулюється під дану електролітичну комірку. При вимірах переміщенням движку реохорду R3 досягають мінімальної сили струму в вимірювальній діагоналі мосту, що контролюється за допомогою мілівольтметру, осцилографу, або по найменший гучності звуку, що контролюється за допомогою телефону.
Принцип дії автоматичного мосту (рисунок 3.23 б) засновано на підсилюванні напруги розбалансу, яка знімається з вимірювальної діагоналі і яка керує переміщенням реверсивного двигуна (РД). Він переміщує движок реохорду Rp до встановлення рівноваги мосту і одночасно покажчик, який фіксує виміряне значення електропровідності.
|
|
|
Пряма кондуктометрія. Залежність питомої електропровідності розчинів електролітів від концентрації дозволяє використовувати кондуктометрію для вимірювання концентрації сульфатної кислоти, розчинів їдкого натру, солей при їх виробництві і там де електропровідність розчинів однозначно визначається вмістом аналізуємої речовини. Оскільки електропровідність розчинів величина адитивна і визначається присутністю усіх іонів у розчині, то пряма кондуктометрія з успіхом використовується для визначення загального вмісту солей природних вод, для контролю якості дистильованої води, яка використовується у хімічних лабораторіях, для контролю вмісту іонізованих домішок у воді, парі, конденсату при експлуатації парових котлів, для швидкого і точного вимірювання вмісту розчиненої речовини.
При визначенні загального вмісту солей природних і побутових вод частіш за усе величину питомої електропровідності перераховують на вміст хлориду натрію в мг/л. Однак, якщо відомий приблизний склад мінеральної води, загальний вміст за питомою електропровідністю слід розраховувати по солі, яка переважно міститься у досліджуваній воді. Зазначимо, що малі значення загального вмісту солей наводять в одиницях питомої електропровідності.
Метод засновано на визначені точці еквівалентності за зміненням електропровідності розчину, яка змінюється у ході титрування. Графічне зображення залежності електропровідності розчину від кількості доданого титранту являє собою криву кондуктометричного титрування. Якщо електропровідність при титруванні змінюється лінійно, то кондуктометрична крива титрування складається з прямих, які перехрещуються у точці еквівалентності. Якщо електропровідність при титруванні змінюється не лінійно, то спостерігається нелінійна залежність. Якщо біля точці еквівалентності має місце плавний перехід кондуктометричної кривої, то точка еквівалентності визначається продовженням прямолінійних частин кривої титрування до їх перетину. При кондуктометричному титруванні не має необхідності визначати сталу комірки, досить бути впевненим, що вона не змінюється. В процесі титрування для отримання різкого злому на кривій титрування необхідно враховувати ефект розведення. Його зводять до мінімуму використовуючи спеціальні комірки, або титруючи значний об’єм речовини, що визначається, концентрованим робочим розчином(зазвичай на порядок вище, ніж концентрація визначаємої речовини.
Метод кондуктометричного титрування дозволяє визначати речовини у багато компонентних сумішах, у забарвлених і мутних розчинах. Недоліком методу є неможливість його застосування у присутності сторонніх електролітів.
Для виконання кондуктометричного титрування збирають пристрій, який зображено на рисунку 3.24. В якості електролітичної комірки використовують або спеціальну комірку, або стакан 4 ємністю 250 мл, в який занурені платинові електроди 7. Подача титранту здійснюється або автоматично з ємності 2 за допомогою пристрою 1, або вручну із бюретки. Електроди з’єднані з вимірювальною схемою 6, яка живиться від джерела 8. Вихід сигналу, який пропорцієн електропровідності, подається на реєстратор 5. Титрант змішується з розчином за допомогою пристрою 3.

1 – пристрій автоматичної подачи титр анту; 2 – ємність для титр анту; 3 – пристрій для змішування розчину; 4 – електролітична комірка; 5 – реєстратор; 6 – вимірювальна схема; 7 – електроди; 8 – джерело живлення.
Рисунок 3.24 - Схема пристрою для кондуктометричного титрування
В кондуктометричному титруванні використовують кислотне-лужні, окислювальне-відновні реакції, реакції осаду та комплексоутворення.
Розглянемо криві титрування на прикладі кислотно-основних реакцій при титруванні розчином NaOH. В цьому випадку можливо визначення кислот, суміші кислот, солі слабких основ, суміші кислот і солі слабких основ. Відповідні криві титрування наведені на рисунку 3.25.
Хід усіх кривих титрування визначається рухомістю іонів, які приймають участь у реакції. Так, при титруванні нітратної кислоти відбувається її нейтралізація:
H+ + NO3- + Na+ + OH- 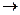 Na+ + NO3- + H2O.
Na+ + NO3- + H2O.

а-нітратної кислоти; б-оцтової кислоти(1-01н; 2-0,001н; 3-0,0001н); в- хлорводнева +борна; г - суміші нітратної кислоти і нітрату амонію; д-хлорводнева + оцтова + хлорид амонію; е- хлор воднева + оцтова +гідро хлорид триетаноламина+фенол.
Рисунок 3.25 - Криві кондуктометричного титрування
В процесі титрування високо рухливі іони гідрогену ( =349,8) заміщуються менш рухливими іонами натрію(
=349,8) заміщуються менш рухливими іонами натрію( =50,1) і електропровідність розчину буде зменшуватися. Після того, як уся кислота буде від титрована, електропровідність почне збільшуватися за рахунок появи іонів ОН-(
=50,1) і електропровідність розчину буде зменшуватися. Після того, як уся кислота буде від титрована, електропровідність почне збільшуватися за рахунок появи іонів ОН-( =197,6). Точка перетину гілок на кривої титрування відповідає точці еквівалентності і об’єму титранту, який пішов на титрування. Несиметричність гілок зумовлена різницею у рухливості іонів гідрогену(
=197,6). Точка перетину гілок на кривої титрування відповідає точці еквівалентності і об’єму титранту, який пішов на титрування. Несиметричність гілок зумовлена різницею у рухливості іонів гідрогену( =349,8) і гідроксилу(
=349,8) і гідроксилу( =197,6). Крива титрування буде мати вигляд як на рисунку 3.32 а.
=197,6). Крива титрування буде мати вигляд як на рисунку 3.32 а.
При титруванні суміші нітратної кислоти і амонію нітрату спочатку електропровідність значно зменшується внаслідок нейтралізації нітратної кислоти і зменшення концентрації іонів гідрогену(рисунку 3.32 в). Коли повністю нейтралізована кислота починається витіснення іонів амонію. Оскільки їх рухомість вище рухомості іонів натрію, електропровідність і далі зменшується, але у меншій мірі. Об’єм титранту у першій точці еквівалентності використовується для визначення кількості нітратної кислоти. Різниця об’ємів титранту, які використані у першій і другій точці еквівалентності використовується для визначення вмісту амонію нітрату.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 6270; Нарушение авторских прав?; Мы поможем в написании вашей работы!