
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сили міжмолекулярної взаємодії
Відхилення, відзначені вище, зумовлені тим, що теорія ідеальних газів не враховує сили, які діють між частинками газу. Ці сили можуть призводити до утворення хімічних сполук – валентні сили. Якщо хімічні сполуки не формуються, то сили взаємодії називають молекулярними силами. Хімічні сили за своєю природою не відрізняються від молекулярних сил. Ті і інші зводяться до електричних взаємодій між елементарними зарядами, з яких побудовано атом чи молекулу; а їх природа розкривається в повній мірі лише в квантовій механіці.
Коротко зупинимось на силах, які утримують окремі атоми в молекулах.
В хімії розрізняють два типа зв’язків, що призводять до утворення молекул: іонний (гетерополярний) та ковалентний (гомополярний).
Теорія іонних зв’язків з’явилась ще до квантової механіки і досить добре описувала суть явища. Ідея про природу іонного зв’язку (валентності) полягає в наступному: гетерополярна валентність елемента визначається кількістю електронів, які необхідно відняти (у електропозитивного елемента) або додати (до електронегативного елемента), щоб отримати іон, який має електронну оболонку найближчого інертного газу. Так від Na необхідно відняти один електрон, щоб отримати оболонку Ne. До Cl необхідно додати один електрон, щоб утворити оболонку Ar. Таким чином, Na+ та Cl - - начебто заряджені атоми інертних газів.
За цих умов основну роль в іонному зв’язку відіграє кулонівське притягування різнойменно заряджених іонів, оскільки електронні оболонки інертних газів хімічно неактивні. Потенціальна енергія при кулонівській взаємодії між іонами
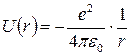 . (1)
. (1)
Разом з цією енергією є також додатна енергія U > 0, пов’язана з дією сил відштовхування між іонами при  . В класичній теорії ці сили не могли бути розраховані, але введення їх здавалось обґрунтованим, оскільки атоми інертних газів відштовхуються один від одного на малих відстанях. Ці сили мають великі значення на малих відстанях та швидко спадають при збільшенні відстані. Внесок енергії цих сил у повну потенціальну енергію взаємодії іонів незначний і не перебільшує 10% від її значення. Тому для оцінки енергії дисоціації молекули NaCl можна використати вираз (1), поклавши
. В класичній теорії ці сили не могли бути розраховані, але введення їх здавалось обґрунтованим, оскільки атоми інертних газів відштовхуються один від одного на малих відстанях. Ці сили мають великі значення на малих відстанях та швидко спадають при збільшенні відстані. Внесок енергії цих сил у повну потенціальну енергію взаємодії іонів незначний і не перебільшує 10% від її значення. Тому для оцінки енергії дисоціації молекули NaCl можна використати вираз (1), поклавши 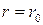 , де
, де 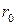 - відстань між іонами.
- відстань між іонами.
До числа молекул, які утворюються завдяки взаємодії іонів протилежних знаків, тобто завдяки іонному зв’язку атомів, належать, наприклад, NaCl, HCl, H2SO4, Al2O3, MgO та ін.
Якщо виділити іони не вдається, то реалізується ковалентний (гомополярний) зв’язок атомів у молекулі.
Використовуючи вище приведений підхід, ніколи не вдавалось пояснити існування молекул, що складаються з двох однакових атомів (H2, O2, N2 та ін.). Немає підстав одному з рівноправних атомів перетворитися в позитивний іон, а іншому – в негативний. Розуміння механізму цього зв’язку дає лише квантова механіка. Відзначимо лише, що при утворенні молекул H2, O2, N2 та ін. основну роль відіграють обмінні сили. Вони виникають із тієї ж кулонівської взаємодії, але необхідно залучати квантово-механічні принципи про тотожність частинок. Однакові атоми наче обмінюються між собою електронами, і неможливо розрізнити, якому з атомів належать їхні електрони. В результаті такого “обміну” електронами між атомами і виникають електростатичні сили квантово-механічного походження. [Матвеев 1981 р., ст. 220-221]
Ми будемо вважати, що хімічні реакції в газі закінчились, і тому хімічними силам надалі цікавитись не будемо.
Міжмолекулярні дисперсійні сили (сили Ван-дер-Ваальса)
Окрім валентних сил, між атомами та молекулами діють ще особливі сили, які мають завжди характер сил притягування - міжмолекулярні дисперсійні сили або сили Ван-дер-Ваальса (на ім’я голландського вченого, що заклав основи молекулярної теорії реальних газів). Особливістю даних сил є те, що 1) вони діють між електрично нейтральними системами і системами, які не мають електричного моменту; 2) ці сили не залежать від температури. Природа цих сил також квантова.
Щоб зрозуміти механізм утворення даних сил, необхідно врахувати дві обставини. По-перше, заряди всередині частинки не знаходяться в одній точці. Завдяки цьому їх поля зовні атома чи молекули не повністю компенсуються. По-друге, у зовнішньому електричному полі положення або рух зарядів всередині молекули змінюється таким чином, що додатні заряди зміщуються в напрямку електричного поля, а від’ємні – в протилежному напрямку. Це явище називається електричною поляризацією. Отже на певній відстані молекули поляризують своїм електричним полем сусідні молекули, і самі поляризуються під дією полів інших молекул, перетворюючись на диполь. Останні подібно магнітам притягуються протилежними полюсами. Дані сили називаються дисперсійними, оскільки поляризацією молекул пояснюється також дисперсія світла, т.б. зміна швидкості світла і показника заломлення середовища.
|
Дата добавления: 2014-01-11; Просмотров: 1060; Нарушение авторских прав?; Мы поможем в написании вашей работы!