
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Критичний стан та його параметри для газу Ван-дер-Ваальса
Якщо побудувати ізотерми Ван-дер-Ваальса для різних температур, можна побачити, що з підвищенням температури ізотерми розташовуються все вище, а максимуми і мінімуми ізотерм зближуються як по вісі абсцис (зближуються три корені V 1, V 2, V 3), так і по вісі ординат (зменшується відповідна різниця тисків). Нарешті, при T=Tкр всі три корені збігаються між собою V 1= V 2= V 3= V кр, а максимум і мінімум ізотерми зливаються, перетворюючись у точку перегину. Це означає, що зникає різниця між різними станами речовини, Tкр і є тією температурою, існування якої є характерною властивістю речовини.
Для знаходження критичних параметрів T кр, р кр і V кр, врахуємо, що рівняння (7) переходить в
 . (8)
. (8)
Оскільки в ньому всі три кореня співпадають і рівні V кр, рівняння повинно приводитись до вигляду
 . (9)
. (9)
Піднесемо його в куб та порівняємо коефіцієнти при однакових степенях. Це дасть три рівняння
 ,
, 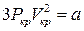 ,
, 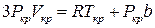 (10)
(10)
 Розв’язавши систему (10), одержимо значення критичних параметрів, виражених через стали a і b
Розв’язавши систему (10), одержимо значення критичних параметрів, виражених через стали a і b
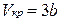 ,
, 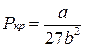 ,
,  (11)
(11)
Значення критичних параметрів (11) можна отримати і в інший спосіб, врахувавши, що для точки перегину повинні виконуватись умови
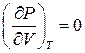 та
та 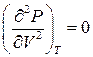 .
.
Значення критичних параметрів для деяких речовин
| Речовина | T кр, K | Р кр, 105Па | V кр, 10-3 м3/кг |
| водень (H2) | 33,2 | 13,29 | 32,26 |
| азот (N2) | 126,0 | 33,93 | 3,22 |
| кисень (O2) | 164,3 | 50,34 | 2,32 |
| хлор (Cl2) | 417,1 | 77,08 | 1,75 |
| водяна пара (H2O) | 647,25 | 220,53 | 2,50 |
Рівняння Ван-дер-Ваальса має велике значення, по-перше, тому, що воно якісно вірно описує поведінку речовини при зміні температури, тиску і об’єму а також факт переходу речовини з газоподібного стану в рідкий і навпаки; по-друге, дозволяє оцінити значення температур і тисків, при яких конденсація газів можлива. Іншими словами, рівняння Ван-дер-Ваальса якісно досить добре описує систему рідина-газ, але в кількісному відношенні дає результати, які відхиляються від даних експерименту.
Головні відхилення полягають в наступному:
1. Для даної речовини a і b в рівнянні Ван-дер-Ваальса повинні бути незалежними від температури. Насправді ж для співпадання ізотерм теоретичних і експериментальних при різних температурах доводиться підбирати різні a і b, тобто a = f (T) і b = f (T).
2. З (10) повинно випливати, що критичний коефіцієнт 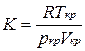 рівен
рівен
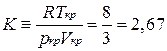
і повинний бути однаковим для всіх речовин. На практиці ж ми для різних речовин отримуємо різні значення. Наприклад, для води 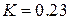 , а для гелію
, а для гелію  . Взагалі-то для легких газів (He, H2 та ін.) теорія і практика збігаються краще, ніж для важких.
. Взагалі-то для легких газів (He, H2 та ін.) теорія і практика збігаються краще, ніж для важких.
3. Співвідношення V кр =3 b, отримане з рівняння, не виконується, більш точне V кр »2 b.
4. В області існування двох фаз рідина-газ рівняння Ван-дер-Ваальса не узгоджується з дослідом.
Теорія Ван-дер-Ваальса має лише якісний характер. Але вона дозволила вперше описати і пояснити широкий клас явищ, пов’язаних з переходами із рідкого стану в газоподібний і навпаки.
4. Закон відповідних станів
Пригадаємо, що ізотерми ідеальних газів не залежать від індивідуальних властивостей газів (якщо ізотерми побудовані для одного моля). Можна і для реальних газів записати рівняння так, щоб воно не залежало від природи газу, тобто було універсальним.
Візьмемо в якості одиниць об’єму, тиску та температури критичні значення цих величин – такі величини називають приведеними

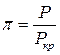 ,
, 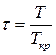 ,
,
 ,
,  ,
, 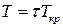 .
.
 Остаточно
Остаточно
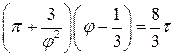 . (12)
. (12)
Це рівняння приймає однаковий для всіх речовин вигляд. Звідси можна зробити висновок, що і поведінка різних речовин повинна бути однаковою. Зокрема, виникає впевненість в тому, що в принципі будь-який газ можна привести в рідкий стан, і можна оцінити температуру і тиск (використовуючи дослідні данні для інших речовин), за яких можлива конденсація газу. (Так було у випадку водню.)
Твердження про еквівалентність поведінки всіх систем рідиа-газ називається законом відповідних станів. Кількісно цей закон формулюється так: якщо два приведених параметра речовин однакові, то і третій параметр також однаковий.
Однак необхідно відзначити, що закон відповідних станів, отриманий з наближення рівняння Ван-дер-Ваальса, не виконується точно реальних газів і рідин.
5. Внутрішня енергія газу Ван-дер-Ваальса
отримаємо спочатку вираз для внутрішньої енергії з молекулярно-кінетичних міркувань. Внутрішня енергія Ван-дер-Ваальса складається з внутрішньої енергії молекул газу і кінетичної енергії руху центру мас молекул, яка в сумі дорівнює C v T, та з потенціальної енергії взаємного притягівання молекул (в моделі пружних кульок силам притягування не відповідає ніяка потенціальна енергія), яка має від’ємне значення. Підкреслимо, що кінетична енергія руху може бути представлена у вигляді C v T лише у випадку, коли C v не залежить від температури,
U = E k+ E n (13)
Потенціальна енергія притягування дорівнює роботі, яку необхідно витратити проти сил притягування для того, щоб молекули розвести на нескінченність, коли взаємодією між ними можна знехтувати, а потенціальна енергія взаємодії рівна нулеві. Молекулярний тиск 
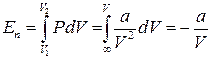 . (14)
. (14)
 Нижня границя інтегрування у формулі (14) обрана такою, щоб потенціальна енергія при ньому дорівнювала нулю. Для внутрішньо енергії газу Ван-дер-Ваальса можна записати вираз
Нижня границя інтегрування у формулі (14) обрана такою, щоб потенціальна енергія при ньому дорівнювала нулю. Для внутрішньо енергії газу Ван-дер-Ваальса можна записати вираз

 (15)
(15)
Цю ж формулу можна отримати і термодинамічними методами. Враховуючи, співвідношення 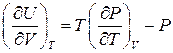 , яке можна отримати, використовуючи другий закон термодинаміки, запишемо вираз для диференціала внутрішньої енергії
, яке можна отримати, використовуючи другий закон термодинаміки, запишемо вираз для диференціала внутрішньої енергії
 . (16)
. (16)
З рівняння Ван-дер-Ваальса випливає, що
 (17)
(17)
тому
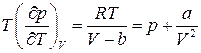 (18)
(18)
І рівняння (16) набуває вигляду:
 (19)
(19)
 Вважаючи, що U = 0 при Т = 0 і V = ∞, з (19) ми отримаємо:
Вважаючи, що U = 0 при Т = 0 і V = ∞, з (19) ми отримаємо:
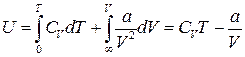 , (20)
, (20)
де C V не залежить від Т.
Отже внутрішня енергія газу Ван-дер-Ваальса залежить також і від його об’єму U=f (T, V).
|
|
Дата добавления: 2014-01-11; Просмотров: 2990; Нарушение авторских прав?; Мы поможем в написании вашей работы!