
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розкиснення з одержанням конденсованих продуктів реакції
|
|
|
|
Види процесів розкиснення
Розгляд обмінних реакцій типу (8.2) дозволяє висновок, що стосовно металу такі реакції можуть мати не тільки окисний, але і відновний характер (якщо реакція зсувається вліво). Для цього варто застосовувати елементи, що мають підвищену спорідненість до кисню й у даних умовах здатні енергійно зв'язувати кисень, звільняючи метал з оксиду. Такі елементи називаються розкиснювачами, а сам процес відновлення металу з оксиду — розкисненням.
Крім розкиснення дією розкиснювачів існує особливий процес — дифузійне розкиснення, на якому ми окремо зупинимося далі.
Розглянемо процеси розкиснення на прикладі сталей, де результатом окисних процесів є утворення розчинного в металі оксида FeО.
При цьому виді розкиснення процес супроводжується утворенням конденсованих оксидів, нерозчинних у металі і спливаючих у шлак. До числа розкиснювачів, що утворять такі оксиди, відносяться титан, кремній, марганець, алюміній і ін.
У загальному виді реакція розкиснення заліза представляється наступним рівнянням:
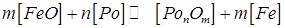 , (217) (8.3)
, (217) (8.3)
де Pо — розкиснювач. Константа рівноваги реакції  Але в сталях [ Fe ] ≈ 1, тому рівноважна концентрація вільного закису заліза в металі
Але в сталях [ Fe ] ≈ 1, тому рівноважна концентрація вільного закису заліза в металі
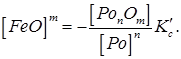
Отже, концентрація вільного закису заліза зменшується з підвищенням вмісту розкиснювача і при зменшенні оксидів даного розкиснювача в металі. Якщо ж врахувати, що розкиснювачами є, як правило, елементи, що утворюють нерозчинні в металі оксиди, які видаляються у шлак, то концентрацію [ PonOm ] можна вважати величиною постійною. Тоді, включаючи величину [ PonOm ] у константу рівноваги реакції, одержимо
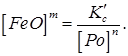 (218) (8.4)
(218) (8.4)
Таким чином, при певних температурах можна установити залежність між концентрацією розкиснювача і концентрацією вільного закису заліза, що знаходиться з ним в рівновазі; тоді, задаючись припустимим вмістом [FeО], визначають концентрацію, що відповідає цьому вмісту, розкиснювача в металі.
|
|
|
У табл. 8.1 приведені дані про найважливіші обмінні реакції розкиснення з одержанням конденсованих оксидів. Як видно з таблиці, ці процеси екзотермічні, тобто супроводжуються виділенням тепла.
Таблиця 8.1
| Реакції | Тепловий эфект, кал |




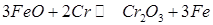

| +187300 +62 994 -- +24 047 -- +35 8J5 |
Розглянемо характерні риси найбільш важливих розкиснювачів цієї групи, що застосовуються в зварювальній техніці.
а) Кремній — Si (T пл = 1440 °С, T кип = 2630 °С, густина γ= 2,37 г/см3). При окиснюванні утворює нерозчинний у металі кислий оксид SiО 2, котрий легко створює комплекси, у тому числі і з FeО. Силікати заліза спливають на поверхню металу і переходять у шлак, унаслідок чого підвищується розкиснююча здатність кремнію.
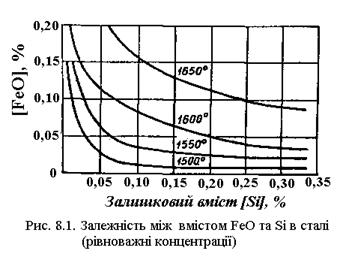 На рис. 8.1 показані ізотерми рівноваги між кремнієм і закисом заліза. Як видно з рисунка, з підвищенням концентрації кремнію в металі зменшується вміст у ньому закису заліза. При цьому розкиснююча здатність кремнію помітно збільшується зі зниженням температури. Оскільки оксиди кремнію збільшують кислотність шлаку, а разом з тим і його в'язкість, уведення кремнію в зварювальну ванну обмежують.
На рис. 8.1 показані ізотерми рівноваги між кремнієм і закисом заліза. Як видно з рисунка, з підвищенням концентрації кремнію в металі зменшується вміст у ньому закису заліза. При цьому розкиснююча здатність кремнію помітно збільшується зі зниженням температури. Оскільки оксиди кремнію збільшують кислотність шлаку, а разом з тим і його в'язкість, уведення кремнію в зварювальну ванну обмежують.
 б) Марганець - Мn (T пл = 1244° С, T кип = 2027° С, густина γ = 7,46 г/см3). При окиснюванні марганець перетворюється в закис МnО - відносно сильний основний оксид, нерозчинний у металі. Закис марганцю утворює із закисом заліза безперервний ряд розчинів як у рідкому, так і у твердому стані. Фізичне взаємне розчинення закису заліза і закису марганцю приводить до зменшення вмісту в шлаку вільного закису заліза, і тому створюються умови для відповідного переходу з металу в шлак нових порцій закису заліза.
б) Марганець - Мn (T пл = 1244° С, T кип = 2027° С, густина γ = 7,46 г/см3). При окиснюванні марганець перетворюється в закис МnО - відносно сильний основний оксид, нерозчинний у металі. Закис марганцю утворює із закисом заліза безперервний ряд розчинів як у рідкому, так і у твердому стані. Фізичне взаємне розчинення закису заліза і закису марганцю приводить до зменшення вмісту в шлаку вільного закису заліза, і тому створюються умови для відповідного переходу з металу в шлак нових порцій закису заліза.
На рис. 8.2 показана залежність концентрації закису заліза від вмісту марганцю в сталі, що відповідає рівноважному стану при різних температурах. Так само як і для кремнію, зі збільшенням вмісту марганцю в металі зменшується концентрація в ньому закису заліза, однак вплив кремнію виявляється сильніше. З рисунка видно, що зі збільшенням температури дія марганцю як відновлювача слабшає.
|
|
|
в) Титан - Tі (T пл = 1750° С, T кип = 3400° С, густина γ = 4,54 г/см3) відноситься до числа сильних розкиснювачів, більш сильних, ніж кремній і марганець.
Кислий оксид ТіО2, що утворюється, нерозчинний в металі, легко вступає в комплекси, котрі переходять у шлак.
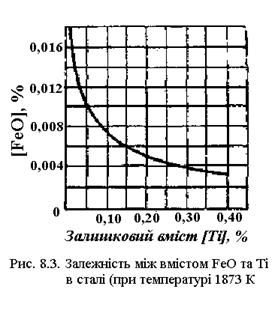
На рис. 8.3 зображена залежність між вмістом закису заліза і титана в металі, що відповідає рівноважним концентраціям, при температурі 1600° С. Тут також зі збільшенням вмісту титана зменшується кількість закису заліза.
 Титан активно реагує з азотом, утворюючи міцні нітриди, нерозчинні в металі. Разом з тим, він є сильним модифікатором, тобто елементом, що сприяє подрібнюванню зерна в металі.
Титан активно реагує з азотом, утворюючи міцні нітриди, нерозчинні в металі. Разом з тим, він є сильним модифікатором, тобто елементом, що сприяє подрібнюванню зерна в металі.
г) Алюміній — Аl (Т пл = 658° С, Т кип = 1800° С, густина γ = 2,7 г/см3) є найбільш сильним розкиснювачем цієї групи. Утворює амфотерний оксид Al2O3. Розкиснення рідкого металу алюмінієм супроводжується значним виділенням тепла, а це забезпечує додатковий підігрів металу зварювальної ванни, що благотворно впливає на перебіг процесів. Однак окис алюмінію погано спливає на поверхню зварювальної панни і частково залишається у шві у виді неметалічних вкраплень. Це є однією з причин незначного застосування алюмінію як розкиснювача при зварюванні сталей.
Як видно з рис. 8.4, розкиснююча здатність алюмінію є досить високою.
Алюміній, як і титан, схильний утворювати з азотом стійкі нітриди.
 Розкиснення з одержанням газоподібних продуктів реакції
Розкиснення з одержанням газоподібних продуктів реакції
Розглянемо дві типові реакції цього виду розкиснення металу.
Розкиснення вуглецем. Цей процес може протікати в два етапи:
а)  ,
,
б) (219) (8.5)
(219) (8.5)
При цьому спостерігається одночасна присутність заліза, закису заліза, вуглецю, окису вуглецю і вуглекислого газу. Де і за яких умов будуть іти ці реакції?
Умови рівноваги між залізом, оксидами заліза, окисом вуглецю і вуглекислим газом для інтервалу температур 400—1300° С наведені на рис. 8.5. Тут можна відзначити три характерні області:
|
|
|
 Область І - стійкого існування відновленого заліза, що зменшується із ростом температури. Цій області відповідає наявність переважно відновного середовища у видіСО.
Область І - стійкого існування відновленого заліза, що зменшується із ростом температури. Цій області відповідає наявність переважно відновного середовища у видіСО.
Область II — стійкого існування закису заліза. Ця область з'являється при температурах, близьких 600 °С, і збільшується з подальшим ростом температури. Їй відповідає наявність окисного середовища, тобто помітних кількостей СО2. Присутність СО2 сприяє окисненню заліза по реакції
Fe + СО2 → Fe + СО,
чи, за наявності магнетиту, відновлення останнього до закису заліза,тобто
Fе3O4 + СО → ЗFеО + СО2.
Область ІІІ - стійкого існування магнетиту Fе3O4, що зменшується з ростом температури (Т > 600° С). Цій області відповідає ще більш сильне окисне середовище, створене присутністю значної кількості СО2. Тому окисні процеси розвиваються далі по реакції
3Fe + СО2 → Fе3O4 + СО.
З огляду на те, що зварювальний процес відбувається при більш високих температурах, ніж розглянуті, варто припустити наступне:
а) при окиснюванні металу стійкою формою оксида заліза буде FeО;
б) розкиснення металу вуглецем йде тільки до утворення окису вуглецю, тому що при високих температурах цей продукт дуже стійкий, тобто по реакції (8.5, а).
Константа рівноваги для цієї реакції  .
.
Звідси визначимо рівноважну концентрацію закису заліза в металі, вважаючи, що вміст заліза в сталі близький до одиниці і виразивши концентрацію окису вуглецю через парціальний тиск РCO:  .
.
 Якщо приблизно вважати, що в процесі зварювання в області високих температур РCO = 1 атм, то
Якщо приблизно вважати, що в процесі зварювання в області високих температур РCO = 1 атм, то
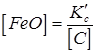 . (220) (8.6)
. (220) (8.6)
На рис. 8.6 показана залежність між рівноважним вмістом закису заліза і вуглецю в металі для різних температур.
Як видно з рисунка, при збільшенні вмісту вуглецю в металі інтенсивно зменшується вміст у ньому закису заліза. У той же час з ростом температури процесу розкиснююча здатність вуглецю підвищується і розкиснення йде значно повніше, ніж при низьких температурах. Однак незважаючи на гарну розкиснюючу здатність вуглець як розкиснювач знаходить обмежене застосування. Це пояснюється двома обставинами:
|
|
|
а) можливістю одержання пор у металі шва, особливо на ділянках металу, що кристалізуються в останню чергу і сильно насичених вуглецем. Природно, що тут найбільш бурхливо може відбуватися вигоряння вуглецю;
б) можливістю підвищення вмісту вуглецю у металі шва, що не завжди припустимо.
• Розкиснення воднем. Розкиснення металу воднем відбувається за рівнянням:
 ,
,
з константою реакції  .
.
Міркуючи аналогічно попередньому, одержимо  .
.
Звідси концентрація закису заліза, що відповідає стану рівноваги, буде
 . (221) (8.7)
. (221) (8.7)
Відновлення металу воднем має багато спільного із процесом відновлення металу окисом вуглецю. Однак водень слабкіше, ніж CO, розкиснює метал. Теплові ефекти при цьому наступні:  кал;
кал;  кал.
кал.
Недоліком водню як розкиснювача є його висока розчинність у металах, що може привести до утворення пор і тріщин.
Говорячи про ефективність розкиснення на основі обмінних реакцій, варто мати на увазі, що навіть в умовах, коли процес плавки сталі відбувається досить довго, не досягається стан рівноваги реакцій розкиснення; при зварюванні відхилення від рівноважних концентрацій будуть ще більшими (у бік більш високого вмісту закису заліза).
З огляду на ці особливості, у зварювальній практиці часто застосовують одночасно кілька розкиснювачів.
 Для порівняння розкиснюючої здатності деяких елементів на рис. 8.7 наведена залежність між рівноважною концентрацією закису заліза і відповідного елемента - розкиснювача при температурі 1600 °С. Очевидно, що найбільшу розкиснюючу силу маєє Аl, потім Ti. Далі, при малих концентраціях розкиснювача — Si, більше 0,2% - С і, нарешті, Мn і Сr.
Для порівняння розкиснюючої здатності деяких елементів на рис. 8.7 наведена залежність між рівноважною концентрацією закису заліза і відповідного елемента - розкиснювача при температурі 1600 °С. Очевидно, що найбільшу розкиснюючу силу маєє Аl, потім Ti. Далі, при малих концентраціях розкиснювача — Si, більше 0,2% - С і, нарешті, Мn і Сr.
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 461; Нарушение авторских прав?; Мы поможем в написании вашей работы!