
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопрос № 4. Технологические параметры и их влияние на взрывопожарную опасность процессов
|
|
|
|
Все технологические процессы протекают при определенных значениях температур, давлений, концентраций, расходов и других факторов, характеризующих технологический режим. Основные факторы, влияющие на скорость процесса, выход и качество продукции, называются технологическими параметрами. Изменение уровней технологических параметров зачастую приводит не только к снижению количества и качества выпускаемой продукции, но и к тяжелым авариям, взрывам и пожарам на производстве.
Различные виды технологических процессов отличаются не только значениями технологических параметров, но и их совокупностью. Например, для большинства химико–технологических процессов первостепенное значение имеют следующие показатели режима: температура, давление, концентрация взаимодействующих веществ, катализатор, объемная скорость (или ее обратная величина – время пребывания вещества в реакционной зоне), степень турбулизации среды. Электрохимические процессы характеризуются, в первую очередь, напряжением, плотностью тока, температурой и концентрацией. Механические процессы – числом оборотов какого–либо устройства (мешалки, ротора, барабана), дисперсностью материала или вязкостью среды.
Изменение агрегатного состояния реагирующих веществ или вида катализатора в химико–технологических процессах приводит к изменению конструкции реакторов и даже принципиальной технологической схемы процесса. Например, в нефтехимических производствах осуществляются процессы жидкофазного и парофазного крекинга нефтепродуктов. Известно три типа установок каталитического крекинга: с неподвижным слоем таблетированного катализатора и реакторами периодического действия; с плотным слоем циркулирующего шарикового катализатора и реактором–регенератором непрерывного действия; с псевдоожиженным слоем циркулирующего микросферического катализатора, реактором и регенератором непрерывного действия. Пожарная опасность процессов, протекающих в аппаратах этих установок, различна и может быть определена только при глубоком и всестороннем анализе условий, влияющих на возникновение факторов опасности с учетом мероприятий, направленных на предотвращения их возникновения и противопожарную защиту.
|
|
|
Такие технологические параметры, как температура, давление, концентрация реагирующих веществ, в соответствии с принципом Ле Шателье влияют на равновесное состояние системы, в которой протекают обратимые химические реакции. Это позволяет технологам подбирать соответствующие условия проведения химико–технологического процесса, чтобы обеспечить максимальную степень превращения.
Повышение температуры процесса влияет на состояние равновесия системы и увеличивает скорость химических реакций. Поэтому регулирование температурного режима оказывает универсальное воздействие на процесс в целях повышения его производительности. Характер воздействия температуры на процесс определяется тепловым эффектом реакции. Зависимости равновесного Хр и действительного Хф выхода продукта от температуры для обратимых эндотермических и экзотермических реакций приведены на рисунок 2 и 3 (W – объемная скорость, причем W1<W2<W3).
Наиболее сильно интенсифицируются при повышении температуры эндотермические обратимые реакции, т.к. ускоряется не только химическая реакция, но и в соответствии с принципом Ле Шателье растет равновесный выход продукта (Рисунок 12). Для экзотермических реакций с повышением температуры действительный выход продукта сначала увеличивается, приближаясь к равновесному, а затем начинает быстро падать (Рисунок 13).
|
|
|
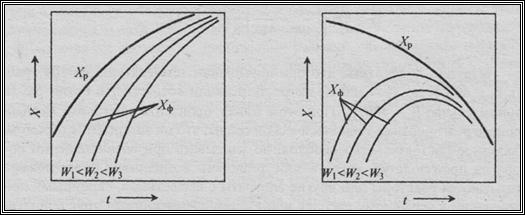
| Рисунок 12 – Зависимость выхода продукта от температуры для эндотермической обратимой реакции | Рисунок 13 – Зависимость выхода продукта от температуры для экзотермической обратимой реакции |
Зависимость скорости реакции от температуры характеризуется температурным коэффициентом скорости реакции β, который показывает во сколько раз увеличивается скорость реакции при увеличении температуры на 10 град. Согласно правилу Вант–Гоффа, температурный коэффициент β большинства химических реакций (в области средних температур и энергий активации) равен 2–4.
Константу скорости реакции Кi при любой температуре Ti можно определить по уравнению Аррениуса:
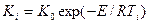
| (2.9) |
| где | Kо | – | предэкспоненциальный множитель; |
| Е | – | энергия активации реакции | |
| R | – | универсальная газовая постоянная; R = 8,314 Дж/(моль К). |
По определению находим
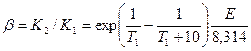
| (2.10) |
Энергии активации многих химических реакций лежат в пределах (0,5–2,0) 105 Дж/моль. Примем Е = 1,0 105 Дж/моль, Т1 = 400 К, Т2 = 410 К (считаем, что температура возросла на 10 градусов). Тогда:
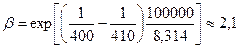
|
Нетрудно подсчитать, что при повышении температуры на 100 град, (от Тi = 400 К до Т2 – 500 К) скорость реакций возрастает в сотни раз (в данном случае β = 409,1). При этом может произойти настолько бурный процесс реагирования технологической среды, что он завершится взрывом. Указанное обстоятельство необходимо учитывать при возникновении пожара на производстве, когда в зоне теплового воздействия очага пожара оказываются реакторы или другие аппараты с веществами, склонными при нагревании к взрывному распаду или взаимодействующими друг с другом со взрывом.
Повышение температуры в производственных условиях ограничено целым рядом технических, технологических и экономических факторов. К ним относятся: недостаточная термическая устойчивость (низкие жаропрочность и жаростойкость) конструкционных материалов, снижение равновесного и фактического выхода продуктов при протекании экзотермических процессов, термическая неустойчивость сырья и готовой продукции, большие затраты на создание высоких температур, повышенная взрывопожарная опасность и ряд других менее важных факторов.
|
|
|
Например, пластмассы начинают деформироваться при температурах ниже 250 °С, обычные конструкционные стали – при 400 °С, высоколегированные стали устойчивы до 700 °С, а специальные сплавы с высоким содержанием никеля, хрома и с добавками других элементов выдерживают повышенные давления при температурах до 800–900 °С. Металлокерамические сплавы (керметы) способны выдерживать температуры до 3000 °С, но без повышенной нагрузки. Для защиты металлических стенок аппаратов от действия высоких температур применяются огнеупорные неметаллические материалы (динас, шамот, графит и др.), которыми футеруют (защищают изнутри) аппараты. В этом случае температуру процессов удается повысить до 1500–2000 °С, а иногда и до 3000 °С и выше. При этом необходимо учитывать, что металлические корпуса таких аппаратов часто охлаждаются водой (имеют водяные рубашки). Любое, даже незначительное, повреждение футеровки приводит к быстрому прогару металлической стенки, бурному, со взрывом, вскипанию воды, разрушению аппарата, цеха, гибели людей.
Применение повышенного давления для процессов, протекающих с уменьшением газового объема, согласно принципу Ле Шателье приводит к увеличению выхода продукта (Рисунок 14).
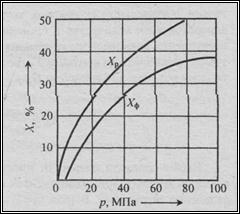
Рисунок 14 – Зависимость фактического выхода аммиака от давления
(катализатор – железо; объемная скорость 30000 ч–1; t=500 0C)
Скорость газовых реакций с повышением давления растет, т.к. при этом увеличивается плотность реакционной смеси и, следовательно, увеличиваются массовые концентрации компонентов. В каталитических процессах влияние давления неоднозначно сказывается на протекание химических реакций, но применять повышенные давления здесь также выгодно, т.к. при этом уменьшается объем газовой смеси, в результате чего снижаются размеры аппаратов и сечения газопроводов, но, к сожалению, увеличиваются толщины стенок оборудования, испытывающих более высокие нагрузки. Скорости жидкофазных процессов заметно увеличиваются только при весьма высоких давлениях, в сотни и тысячи раз превышающих атмосферное. Так, при относительном росте давления в тысячи раз скорость процессов полимеризации некоторых жидких мономеров увеличивается только в десятки раз. На повышение равновесного выхода каталитических процессов, протекающих со значительным увеличением газового объема, благотворно влияет понижение давления. Поэтому некоторые процессы (дегидрирования, дегидратации и другие) ведут под вакуумом.
|
|
|
Повышение концентрации взаимодействующих компонентов в сырье приводит к увеличению движущей силы процесса ∆С и, как следствие, к увеличению скорости его протекания, что видно из следующего выражения скорости любого химического гомогенного или гетерогенного процесса (без фазовых превращений в системе):
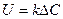
| (2.11) |
Константа, или коэффициент скорости процесса, k представляет собой сложную величину, которая зависит не только от химических свойств реагирующих веществ, но и от их физических характеристик, конструкции аппаратов, гидродинамики процессов и многих других факторов.
Движущая сила процесса выражается через разности действительных и равновесных концентраций реагирующих веществ. Поэтому к увеличению скорости процесса приводит уменьшение равновесной концентрации, что достигается смещением равновесия за счет изменения температуры или давления процесса (влияние этих параметров на протекание процессов было рассмотрено выше) или отводом продуктов реакции из зоны взаимодействия. Увеличение концентрации компонентов в твердом сырье достигается его обогащением, а в жидком и газообразном – концентрированием. Однако чрезмерное повышение концентрации реагентов во многих экзотермических химических реакциях недопустимо вследствие трудности отвода тепла из зоны реакции, что может привести к выходу из строя оборудования, катализатора или к взрыву, т.к. реакционная смесь становится взрывоопасной.
Объемная скорость W (под объемной скоростью понимают объемный расход исходной смеси, отнесенный к единице объема реакционной зоны) влияет как на выход продукта, так и на производительность реактора. Рассмотрим это на примере процесса синтеза аммиака. Т.к. объемная скорость представляет собой величину обратную времени пребывания реакционной смеси в зоне реакции, то ее увеличение приводит к снижению выхода продукта. Из графика, приведенного на рисунок 5, видно, что увеличение объемной скорости в 8 раз приводит к некоторому снижению максимального выхода аммиака (почти в 2 раза), однако производительность реактора по аммиаку в целом возрастает более чем в 4 раза.
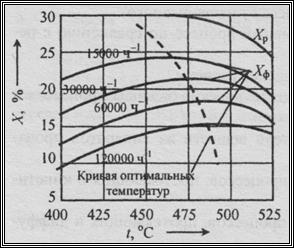
Рисунок 15 – Зависимость выхода аммиака от температуры при давлении 30 МПа
Для многих других производств также характерно повышение производительности процесса при увеличении объемной скорости, но с уменьшением равновесного выхода продукта за один цикл (Рисунок 12. Рисунок 13).
Следует учитывать, что с увеличением объемной скорости растет и гидравлическое сопротивление системы, для преодоления которого необходимо повышать давление исходной реакционной смеси, что связано с дополнительными энергетическими затратами, а также опасностью разгерметизации оборудования.
Катализ – наиболее эффективное средство ускорения большинства химических реакций. Применение катализаторов способствует увеличению не только производительности оборудования, но и качества получаемых продуктов, т.к. катализаторы обладают селективностью (ускоряют основные реакции и тормозят параллельные и побочные). При проведении каталитических процессов часто отпадает необходимость очистки продуктов реакции и их концентрирования, но возникает необходимость более глубокой очистки исходного сырья от вредных примесей – каталитических ядов. Применение катализаторов способствует значительному снижению температуры процессов, что уменьшает и энергетические затраты и их взрывопожарную опасность. В то же время необходимо учитывать, что некоторые катализаторы и инициаторы сами по себе обладают повышенной взрывопожароопасностью.
ВЫВОД ПО ВОПРОСУ:
Оптимальное значение параметров технологического режима соответствует максимальной производительности аппарата при минимальных сырьевых, энергетических и трудовых затратах. Все технологические параметры взаимосвязаны и в значительной степени обусловливают друг друга. Поэтому задача оптимизации процесса даже по одному из показателей является достаточно сложной, так как изменение одного из параметров влечет за собой резкое изменение оптимальных значений других параметров режима.
Технологические параметры влияют на скорость процессов, их технико–экономические показатели, на конструктивное устройство аппаратов, а также на пожаровзрывоопасность производств.
ВОПРОСЫ ДЛЯ КОНТРОЛЯ И САМОПРОВЕРКИ:
1. Что такое технологическая схема процесса, и какими они могут быть?
2. Что такое технологические параметры процесса?
3. Какой технологический параметр оказывает универсальное воздействие на процесс и почему?
4. Как зависит скорость реакции от температуры, и какая при этом возникает опасность?
5. Как влияет давление на выход продукта и скорость процесса и чем опасно его повышение?
6. Как влияет концентрация взаимодействующих компонентов в сырье на скорость протекания процесса и чем опасно ее повышение?
7. Как влияет объемная скорость на выход продукта и производительность установки и чем опасно ее повышение?
8. Для чего применяются катализаторы и как они влияют на взрывопожарную опасность процессов?
9. Что такое процесс производства?
10. Какие бывают виды сырья и как оно влияет на пожарную опасность производства?
11. Что такое производительность цеха (установки) и ее мощность?
12. Что такое интенсивность работы аппарата и как она влияет на пожарную опасность процесса?
13. Чем отличается периодический процесс от непрерывного?
14. Что такое технологическая схема процесса и какими они могут быть?
15. Какие преимущества имеет непрерывный процесс по сравнению с периодическим?
16. На основании чего производят технологические расчеты?
17. На чем основаны материальные и энергетические балансы процессов и для чего их составляют?
18. Какую опасность представляют потери веществ из аппаратов производственных установок?
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 10051; Нарушение авторских прав?; Мы поможем в написании вашей работы!